题目内容
9.某100mL硝酸和硫酸的混合液,其中硝酸的物质的量浓度为0.4mol/L,硫酸的物质的量浓度为0.1mol/L,向混合液中加入1.92g铜粉,微热,待充分反应后,试求(1)产生气体的体积;
(2)Cu2+的物质的量浓度.
分析 n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.06mol,Cu和稀硝酸的离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据方程式知,如果0.03molCu完全反应需要氢离子的物质的量是0.08mol>0.06mol,所以氢离子不足量,应该以氢离子为标准计算;
(1)根据氢离子和NO之间的关系式计算NO体积;
(2)根据氢离子和铜离子之间的关系式计算铜离子浓度.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=0.4mol/L×0.1L=0.04mol,n(H2SO4)=0.1mol/L×0.1L=0.01mol,n(H+)=n(HNO3)+2n(H2SO4)=0.06mol,Cu和稀硝酸的离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据方程式知,如果0.03molCu完全反应需要氢离子的物质的量是0.08mol>0.06mol,所以氢离子不足量,应该以氢离子为标准计算;
(1)设生成NO物质的量为x,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
8mol 2mol
0.06mol x
8mol:2mol=0.06mol:x
x=$\frac{2mol×0.06mol}{8mol}$=0.015mol,
V(NO)=0.015mol×22.4L/mol=0.336L,
答:产生NO体积为0.336L;
(2)设生成铜离子物质的量是y,
3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
8mol 3mol
0.06mol y
8mol:3mol=0.06mol:y
y=$\frac{3mol×0.06mol}{8}$=0.0225mol,
铜离子物质的量浓度=$\frac{0.0225mol}{0.1L}$=0.225mol/L,
答:铜离子浓度是0.225mol/L.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查分析计算能力,正确判断以哪种物质为标准进行计算是解本题关键,注意要进行过量计算,为易错题.


| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
①一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
②当一个可逆反应达到平衡状态时,正、逆反应速率相等
③平衡状态是一种静止的状态,反应物和生成物的浓度不再改变
④化学反应的限度不可以通过改变条件而改变.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
| A. | Al→Al2O3→Al(OH)3→NaAlO2 | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | N2→NO→NO2→HNO3 | D. | S→SO3→H2SO4→MgSO4 |
| A. | 酒精和碘 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙酸和水 |
| A. | CH2=CH2+Br2→BrCH2CH2Br | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 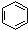 +HNO3$\stackrel{浓硫酸△}{→}$ +HNO3$\stackrel{浓硫酸△}{→}$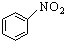 +H2O +H2O | |
| D. | C6H12O6$→_{△}^{催化剂}$2C2H5OH+2CO2↑ |
| A. | 容器里的压强不随时间的变化而改变 | |
| B. | 单位时间内生成2mol HBr的同时,消耗1 mol H2 | |
| C. | 单位时间内生成2mol HBr的同时,生成1 mol H2 | |
| D. | 正反应和逆反应速率都相等,都等于0 |

 .
. .
. ;CH2=CH2和
;CH2=CH2和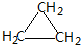 .
.