题目内容
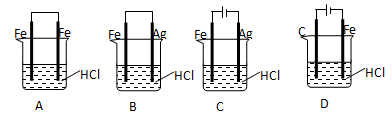
将0.1 L含有0.02mol CuSO4和0.01 molNaCl的水溶液用惰性电极电解。电解一段时间后,一电极上得到0.01 mol Cu,另一电极析出的气体
| A.只有Cl2 | B.既有Cl2又有O2 | C.只有O2 | D.只有H2 |
B
解决本题学生应熟记电解时阴阳极离子放电顺序,并理解电解就是氧化还原反应,抓住氧化还原反应实质就是电子转移,其特征是:电子得失相等。
阴极反应:Cu2+ + 2e- =" Cu"
生成0.01 mol Cu 转移电子共:0.01×2 =" 0.02" mol
阳极反应:若只有 2Cl-- 2e- = Cl2↑ 则转移电子只有:0.01 mol
对应得氯气为:0.01÷2 =" 0.005" mol
因此:阳极反应还有:4OH-- 4e- = 2H2O + O2↑ 并且此反应中转移电子为:0.01mol
对应得氧气为:0.01÷4 =" 0.0025" mol

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
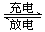 NiOOH + MH,下列叙述正确的是( )
NiOOH + MH,下列叙述正确的是( )