题目内容
(9分)25℃时,有0.01 mol•L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式
(2)达平衡时,溶液中氢离子浓度是多少?(25℃时,醋酸的电离平衡常数为1. 75×10 -5)
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+)、c (CH3COO-)、c (CH3COOH) 是否又发生变化? 电离常数是否发生变化? 为什么 ?
【答案】
(1)K=  (2)4.18×10 -4 mol•L-1
(2)4.18×10 -4 mol•L-1
(3)c(H+)增大 c (CH3COO-)减小 c (CH3COOH)增大 电离常数不变,因为电离常数只受温度影响,温度不变,电离常数不变
【解析】(1)电离平衡常数和化学平衡常数是类似的,所以醋酸的电离平衡常数表达式为K=  。
。
(2)醋酸的电离方程式为CH3COOH CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度
CH3COO-+H+,即溶液中氢离子浓度和CH3COO-的浓度是相同的。又因为醋酸的电离程度很弱,所以溶液中醋酸的浓度近似是0.01mol/L,所以氢离子的浓度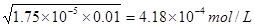 。
。
(3)电离常数和温度,所以是不变的。加入盐酸,增大氢离子的浓度,抑制醋酸的电离,所以c (CH3COO-)减小,c (CH3COOH)增大。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目