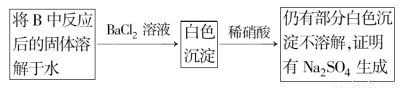
题目内容
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k= (要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
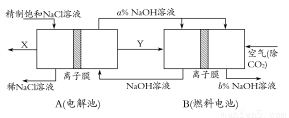
①图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 ;
②分别写出燃料电池B中正极、负极上发生的电极反应,正极: ;负极: ;
③这样设计的主要节(电)能之处在于(写出2处) 、 。
(1)k=Mr(Cl2)/2Mr(NaOH)=71/80=1∶1.13或0.89
(2)③①②
(3)①Cl2 H2 a%<b%
②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O
③燃料电池可以补充电解池消耗的电能 提高产出碱液的浓度,降低能耗(其他合理答案也可)
【解析】(1)据化学方程式2NaCl+2H2O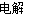 2NaOH+H2↑+Cl2↑即可计算出k值.
2NaOH+H2↑+Cl2↑即可计算出k值.
(2)把Na2CO3放在BaCl2之后,以除去过量的Ba2+;把盐酸放在NO2CO3之后,以除去过量的CO32-。
(3)判断出二极是解答二池问题的前提:燃料电池中通空气(氧化剂)的一极应为正极,所以:①Y(通入负极,还原剂)必为H2,继而H2产生于电解池的阴极,可推出产生于电解池阳极的X必为Cl2;a% NaOH进入燃料电池,出来后的浓度变化可用二种方法判断:[方法一]从Na+的移动方向来定:Na+向阴极(即正极)移动,所以正极b% NaOH浓度增大,负极流出的NaOH变稀;[方法二]从水、OH-的量变来定:负极H2-2e-+2OH-=2H2O,水增多、OH-减少,变稀;正极O2+4e-+2H2O=4OH-,水减少、OH-增多,所以正极增浓,即a<b。

某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
根据上述实验现象,判断以下结论中正确的是( )
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4,振荡,静置 | CCl4层呈橙红色 |
③ | 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥