题目内容
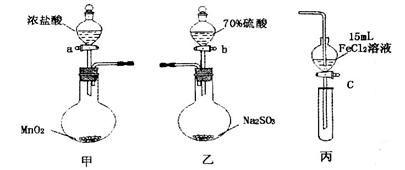
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:

(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
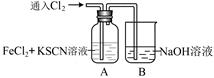
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。

(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
(1)Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
(2)该固体不一定只是Fe3O4,当黑色固体是Fe3O4和FeO,或Fe3O4和Fe,或Fe3O4、FeO和Fe时,也都有上述现象。
(3)溶液中的Fe3+被还原为Fe2+溶液中的+3铁被氧化成更高价态的铁
(4)Fe+H2O=FeO+H2
(2)该固体不一定只是Fe3O4,当黑色固体是Fe3O4和FeO,或Fe3O4和Fe,或Fe3O4、FeO和Fe时,也都有上述现象。
(3)溶液中的Fe3+被还原为Fe2+溶液中的+3铁被氧化成更高价态的铁
| 实验操作 | 预期现象 |
| 取少量褪色的溶液,滴加20%KSCN溶液 | 如果溶液变红色 |
| 或取少量褪色后的溶液,加入0.1mol/LFeCl3溶液 | 或如果溶液不变红色 |
(4)Fe+H2O=FeO+H2
(1)四氧化三铁可以写作Fe2O3·FeO,所以四氧化三铁与盐酸反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O。
(2)由于该黑色固体不一定只是Fe3O4,当黑色固体是Fe3O4和FeO,或Fe3O4和Fe,或Fe3O4、FeO时,也都有上述现象,所以结论是不准确的。
(3)溶液显红色,是因为Fe3+离子与SCN-反应而显色。如果红色逐渐褪色,则可能的原因是氯水有强氧化性,将溶液中SCN-氧化;或者空气中有还原性物质,将溶液中Fe3+还原为Fe2+;或者氯水有极强的氧化性,将溶液中的+3价铁氧化为更高的价态。如果是由于氯水有强氧化性,将溶液中的SCN-氧化,则可以向反应后的溶液中继续加入足量的KSCN溶液,如果溶液显红色,则说明假设1是正确的。或者取少量褪色后的溶液,加入加入0.1mol/LFeCl3溶液,如果溶液不变红色,则假设1是正确的。
(4)不能被磁铁吸收,说明没有铁。当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色,这说明溶液中含有Fe2+,因此黑色固体是FeO。故,
Fe+H2O=FeO+H2。
(2)由于该黑色固体不一定只是Fe3O4,当黑色固体是Fe3O4和FeO,或Fe3O4和Fe,或Fe3O4、FeO时,也都有上述现象,所以结论是不准确的。
(3)溶液显红色,是因为Fe3+离子与SCN-反应而显色。如果红色逐渐褪色,则可能的原因是氯水有强氧化性,将溶液中SCN-氧化;或者空气中有还原性物质,将溶液中Fe3+还原为Fe2+;或者氯水有极强的氧化性,将溶液中的+3价铁氧化为更高的价态。如果是由于氯水有强氧化性,将溶液中的SCN-氧化,则可以向反应后的溶液中继续加入足量的KSCN溶液,如果溶液显红色,则说明假设1是正确的。或者取少量褪色后的溶液,加入加入0.1mol/LFeCl3溶液,如果溶液不变红色,则假设1是正确的。
(4)不能被磁铁吸收,说明没有铁。当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色,这说明溶液中含有Fe2+,因此黑色固体是FeO。故,
Fe+H2O=FeO+H2。

练习册系列答案
相关题目

 。
。
 图中单质可能为( )
图中单质可能为( )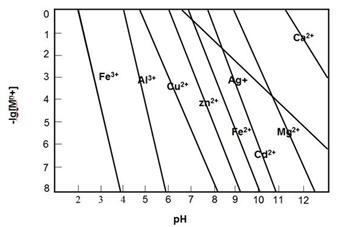
 R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
R2Cu(有机相)+2H+(水相),已知其它阳离子与该有机物不能发生反应,也不相溶。请设计实验方案,验证有机相中含有铜元素。
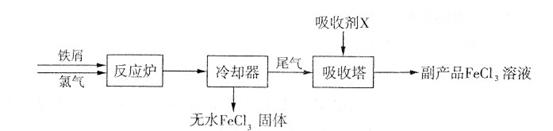
 +A。则A的化学式为 。
+A。则A的化学式为 。