题目内容
(一)写出有关反应的离子方程式:
(1)硫酸氢钠溶液与碳酸氢钠溶液的反应______;
(2)硫化亚铁投入稀硫酸中反应______;
(3)向Na2CO3溶液中加入少量稀盐酸______;
(4)向碳酸氢钙溶液中加入少量烧碱溶液______.
(二)某无色溶液,由Na+、Ag+、Ba2+、Al3+、Al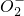 、Mn
、Mn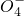 、C
、C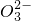 、S
、S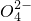 中的若干种组成,取该溶液进行如下实验:
中的若干种组成,取该溶液进行如下实验:
①取适量试液,加入过量盐酸,有气体生成,并得到溶液;
②在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出.
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是______;
(2)一定存在的离子是______.
解:(一)(1)硫酸氢钠溶液与碳酸氢钠溶液的反应的实质为H+与HCO3-反应,其离子反应为H++HCO3-═CO2↑+H2O,故答案为:H++HCO3-═CO2↑+H2O;
(2)硫化亚铁投入稀硫酸中反应的实质为FeS与H+反应,其离子反应为FeS+2H+═Fe2++H2S↑,故答案为:FeS+2H+═Fe2++H2S↑;
(3)向Na2CO3溶液中加入少量稀盐酸生成NaHCO3和NaCl,反应实质为CO32-与H+反应生成HCO3-,其离子反应为CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;
(4)向碳酸氢钙溶液中加入少量烧碱溶液的反应实质为Ca2+和HCO3-、OH-反应,其离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故答案为:Ca2++HCO3-+OH-═CaCO3↓+H2O;
(二)因MnO4-在溶液中为紫色,则无色溶液中一定没有MnO4-,由①可知一定含有CO32-,则没有Ag+、Ba2+、Al3+,由在①所得溶液中再加入过量碳酸氢铵溶液可知生成的气体为二氧化碳,沉淀甲为Al(OH)3,则溶液中一定存在AlO2-,由在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出可知,生成的气体为氨气,沉淀乙中一定含有BaCO3,可能含有BaSO4,即溶液中可能含有SO42-,又溶液不显电性,则一定存在的阳离子为Na+,
(1)综上所述,溶液中一定不存在的离子为Ag+、Ba2+、Al3+、MnO4-,故答案为:Ag+、Ba2+、Al3+、MnO4-;
(2)一定存在的离子为Na+、CO32-、AlO2-,故答案为:Na+、CO32-、AlO2-.
分析:(一)(1)硫酸氢钠溶液与碳酸氢钠溶液的反应的实质为H+与HCO3-反应;
(2)硫化亚铁投入稀硫酸中反应的实质为FeS与H+反应;
(3)向Na2CO3溶液中加入少量稀盐酸生成NaHCO3和NaCl,反应实质为CO32-与H+反应;
(4)向碳酸氢钙溶液中加入少量烧碱溶液的反应实质为Ca2+和HCO3-、OH-反应;
(二)因MnO4-在溶液中为紫色,则无色溶液中一定没有MnO4-,由①可知一定含有CO32-,则没有Ag+、Ba2+、Al3+,由②可知生成的气体为二氧化碳,沉淀甲为Al(OH)3,则溶液中一定存在AlO2-,由③可知,生成的气体为氨气,沉淀乙中一定含有BaCO3,可能含有BaSO4,再利用溶液为电中性来分析.
点评:本题考查离子方程式的书写、离子的共存、离子的检验等知识点,涉及与量有关的离子反应是学生解答的难点,注意利用以少定多的方法来分析解答,难点不大.
(2)硫化亚铁投入稀硫酸中反应的实质为FeS与H+反应,其离子反应为FeS+2H+═Fe2++H2S↑,故答案为:FeS+2H+═Fe2++H2S↑;
(3)向Na2CO3溶液中加入少量稀盐酸生成NaHCO3和NaCl,反应实质为CO32-与H+反应生成HCO3-,其离子反应为CO32-+H+═HCO3-,故答案为:CO32-+H+═HCO3-;
(4)向碳酸氢钙溶液中加入少量烧碱溶液的反应实质为Ca2+和HCO3-、OH-反应,其离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故答案为:Ca2++HCO3-+OH-═CaCO3↓+H2O;
(二)因MnO4-在溶液中为紫色,则无色溶液中一定没有MnO4-,由①可知一定含有CO32-,则没有Ag+、Ba2+、Al3+,由在①所得溶液中再加入过量碳酸氢铵溶液可知生成的气体为二氧化碳,沉淀甲为Al(OH)3,则溶液中一定存在AlO2-,由在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出可知,生成的气体为氨气,沉淀乙中一定含有BaCO3,可能含有BaSO4,即溶液中可能含有SO42-,又溶液不显电性,则一定存在的阳离子为Na+,
(1)综上所述,溶液中一定不存在的离子为Ag+、Ba2+、Al3+、MnO4-,故答案为:Ag+、Ba2+、Al3+、MnO4-;
(2)一定存在的离子为Na+、CO32-、AlO2-,故答案为:Na+、CO32-、AlO2-.
分析:(一)(1)硫酸氢钠溶液与碳酸氢钠溶液的反应的实质为H+与HCO3-反应;
(2)硫化亚铁投入稀硫酸中反应的实质为FeS与H+反应;
(3)向Na2CO3溶液中加入少量稀盐酸生成NaHCO3和NaCl,反应实质为CO32-与H+反应;
(4)向碳酸氢钙溶液中加入少量烧碱溶液的反应实质为Ca2+和HCO3-、OH-反应;
(二)因MnO4-在溶液中为紫色,则无色溶液中一定没有MnO4-,由①可知一定含有CO32-,则没有Ag+、Ba2+、Al3+,由②可知生成的气体为二氧化碳,沉淀甲为Al(OH)3,则溶液中一定存在AlO2-,由③可知,生成的气体为氨气,沉淀乙中一定含有BaCO3,可能含有BaSO4,再利用溶液为电中性来分析.
点评:本题考查离子方程式的书写、离子的共存、离子的检验等知识点,涉及与量有关的离子反应是学生解答的难点,注意利用以少定多的方法来分析解答,难点不大.

练习册系列答案
相关题目