��Ŀ����
����Ŀ������������Al2O3��H2O��Al2O3��3H3OΪ������������Fe2O3��SiO2 �� Ϊ��ȥɰ��������������������Ʒ�����
��1��������Ƶ����ַ����У��������ֿ��Ǿ���Ч����ǣ����ţ���
��2�����ᴿʱ�õ�ԭ�ϳ�������ˮ�⣬��������������������ѡ��Na2CO3 �� ��CaCO3 �� ��H2SO4 �� ��HCl����KOH����д���й���Ҫ��Ӧ�Ļ�ѧ����ʽ�������ӷ�Ӧ��Ҫд���ӷ���ʽ������
���𰸡�
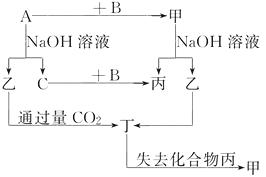
��1��A
��2��Al2O3��2OH��=2AlO2-��H2O��2AlO2-��3H2O��CO2=Al��OH��3����CO32- �� 2Al��OH��3 ![]() Al2O3��3H2O��CaCO3
Al2O3��3H2O��CaCO3 ![]() CaO��CO2����CaO��H2O=Ca��OH��2 �� Ca��OH��2��CO32-=CaCO3��2OH��
CaO��CO2����CaO��H2O=Ca��OH��2 �� Ca��OH��2��CO32-=CaCO3��2OH��
��������B����δ���Ǿ���Ч�棬�ҹ��̸��ӡ���A����������ҩƷ���ɻ��գ���Ʒ�Ƚϴ�����A�еļ�Ӧ��NaOH��A��������CaCO3����CO2��CaO��CaO��ˮ��Ӧ�õ�Ca��OH��2 �� ����Ca��OH��2��Na2CO3��Ӧ����CaCO3��NaOH���������ɳ���aʱ�ֵõ�Na2CO3 �� ���Կ��Ի�������Na2CO3��

����Ŀ����ΪԪ�����ڱ��е�һ���֣��г�10��Ԫ����Ԫ�����ڱ��е�λ�ã�����Ԫ�ط��š����ӷ��Ż�ѧʽ�ش��������⣮
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� | �� |
��1���٢ۢ�����Ԫ������������Ӧˮ�����У�������ǿ���������ѧʽ��
��2��Ԫ�آߵ��⻯�ﳣ���º�Ԫ�آڵĵ��ʷ�Ӧ�Ļ�ѧ����ʽ��
��3���ٺ͢���Ԫ���γ��ĺ˻�����ĵ���ʽ �� �������к��еĻ�ѧ������Ϊ��
��4���ٵ�����������Ӧˮ����͢ݵ�������������Ӧ�����ӷ���ʽΪ ��