题目内容
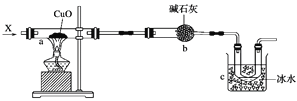
【题目】0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各为0.4mol。将A通入溴的四氯化碳溶液中,溶液褪色(反应原理与通入溴水一样),试回答:
(1)烃A的结构式为_________________________________。
(2)将A通入溴的四氯化碳溶液中,有关反应的方程式为_______________________。
(3)有机物B比A在分子组成上多一个CH2原子团,结构与A相似。写出B在一定条件下生成高分子化合物的化学方程式________________________________________________。
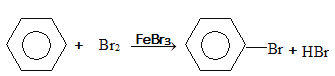
(4)写出苯与液溴反应的化学方程式_________________________________________。
【答案】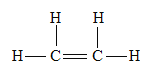 CH2=CH2+Br2
CH2=CH2+Br2![]() CH2BrCH2Br
CH2BrCH2Br 
【解析】
(1)0.2mol烃(设烃的分子式为CxHy),完全燃烧生成0.4molCO2和0.4molH2O,根据质量守恒定律,可以得到0.2x=0.4(碳原子守恒);0.2y=0.4×2(氢原子守恒),解的x=2,y=4,故该烃为乙烯,其结构式为: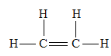 。
。
(2)乙烯与溴发生加成反应,其化学方程式为:CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
(3)有机物B比乙烯多一个CH2,故B为丙烯,在一定条件下发生加聚反应,其化学方程式为: 。
。
(4)苯与液溴在溴化铁作用下发生取代反应生成溴苯与HBr,其化学方程式为: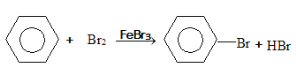 。
。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
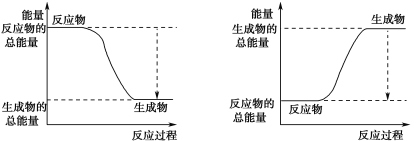
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止