题目内容
13.已知Fe2(SO4)3的物质的量浓度为3mol/L,写出Fe2(SO4)3的电离方程式Fe2(SO4)3=2Fe3++3SO42-,Fe3+和SO${\;}_{4}^{2-}$的物质的量浓度分别为:6mol/L,9mol/L.分析 硫酸铁在溶液中完全电离出 铁离子和硫酸根离子;根据硫酸铁的化学式可知:c(Fe3+)=2c[Fe2(SO4)3]、c(SO42-)=3c[Fe2(SO4)3],据此计算出铁离子和硫酸根离子的浓度.
解答 解:硫酸铁属于强电解质,电离时电离出自由移动的铁离子和硫酸根离子,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-;
Fe2(SO4)3的物质的量浓度为3mol/L,则c(Fe3+)=2c[Fe2(SO4)3]=3mol/L×2=6mol/L;
c(SO42-)=3c[Fe2(SO4)3]=3mol/L×3=9mol/L
故答案为:Fe2(SO4)3=2Fe3++3SO42-;6mol/L;9mol/L.
点评 本题考查了电离方程式的书写、物质的量浓度的计算,题目难度中等,明确物质的量浓度的表达式为解答关键,注意掌握电离方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
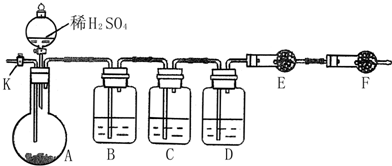
1.如图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)( )

| A. | 压缩后U型管内左侧液面下降,右侧液面上升 | |
| B. | 对于2NO2?N2O4平衡体系,向生成N2O4的方向移动 | |
| C. | 左侧气体颜色先变深后逐渐变浅(比原来深) | |
| D. | 若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平 |
8.下列离子反应方程式正确的是( )
| A. | 硫酸铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | NaHCO3溶液中加入氢氧化钠溶液:OH-+HCO3-═CO2↑+H2O |
18.一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是( )
| A. | 2A+B?2C | B. | A+B?2C | C. | 2A+B?C | D. | 2A+B?4C |
2.下列说法中,正确的是( )
| A. | 反应产物的总能量大于反应物的总能量时,△H<0 | |
| B. | 已知反应H2(g)+I2(g)?2HI(g)平衡常数为K,则2H2(g)+2I2(g)?4HI(g)的平衡常数为2K | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,不能改变化学反应进行的方向 |
3.化学中常用图象直观地描述化学反应的进程或结果.如图图象描述正确的是( )
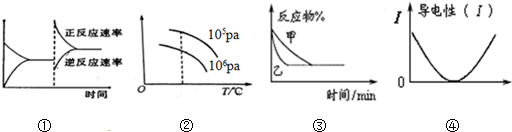

| A. | 图①可表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 图②可表示对“2SO2(g)+O2(g)?2SO2 (g)△H<0”的平衡体系改变T、P后反应物转化率的变化 | |
| C. | 图③可表示使用催化剂对可逆反应C(s)+H2O(g)?CO(g)+H2(g)的影响 | |
| D. | 图④表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 |