题目内容
下列离子方程式正确的是( )
| A.向次氯酸钙溶液通入SO2:Ca2++2ClO?+SO2+H2O= CaSO3↓+2HClO |
| B.向NH4A1(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全 NH4++Al3++2Ba2++2SO42-+4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| C.向Mg(HCO3)2溶液中加入过量的NaOH溶液: Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
D.向硝酸银溶液中滴加稀氨水至过量: Ag+ + NH3?H2O = AgOH↓ + NH4+ Ag+ + NH3?H2O = AgOH↓ + NH4+ |
B
解析试题分析:A.HClO有强氧化性,能把CaSO3氧化成CaSO4.错误。B符合反应的实质。正确。
C.Mg2+ + 2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O.D.Ag+ + 3NH3?H2O =[Ag(NH3)2] ++OH- + NH4++2H2O.
考点:考查离子方程式的正确书写的知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子组能大量共存的是
| A.含大量Al3+的溶液中:K+、Na+、NO3-、S2- |
| B.含大量AlO2-的溶液中:Na+、K+、NO3-、H+ |
| C.含大量H+的溶液中:I-、Cl-、NO3-、Na+ |
| D.含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
下列各组离子在相应的条件下可能大量共存的是( )
| A.能使pH试纸变红的溶液中:CO32-、Ba2+、Cl-、Na+ |
| B.由水电离产生的c(OH-)=1×10-10 mol/L的溶液中:NO3-、Mg2+、SO42-、Fe2+ |
| C.在c(OH-)/c(H+)=1×1012的溶液中:AlO2-、CO32-、Na+、K+ |
| D.无色透明溶液中:Al3+、HCO3-、Cl-、K+ |
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.铈(Ce)元素在自然界中主要以单质形式存在 |
| B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑ |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+ |
D.四种稳定的核素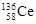 、 、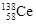 、 、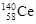 、 、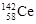 ,它们互称为同位素 ,它们互称为同位素 |
取少量无机盐溶液试样,对其中的离子进行检验,下列判断正确的是
| A.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定含CO32- |
| B.加入KSCN溶液,无明显现象,再滴加几滴新制氯水,溶液变为血红色,则试样中一定含Fe2+ |
| C.加入BaCl2溶液,产生白色沉淀,再加入过量的稀盐酸酸化,沉淀不溶解,则试样中一定含SO42- |
| D.在酒精灯火焰上灼烧,火焰为黄色,则试样中一定含钠元素,一定不含钾元素 |
将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
| A.Fe2+、CH3COO-、Na+、SO42- | B.K+、Ca2+、HCO3-、Cl- |
| C.Al3+、NH4+、Cl-、NO3- | D.K+、Na+、SiO32-、AlO2- |
下列物质能导电,且属于电解质的是
| A.二氧化硫的水溶液 | B.熔融态氯化钠 | C.铜 | D.冰醋酸 |
下列叙述正确的是( )
| A.液态HCl不导电,所以HCl是非电解质 |
| B.NH3的水溶液能够导电,所以NH3是电解质 |
| C.液态Cl2不导电,所以Cl2是非电解质 |
| D.BaSO4在熔融状态下能导电,所以BaSO4是电解质 |
