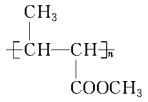
题目内容
【题目】镍氢电池具有性能好、寿命长等优点,其反应原理是NiO(OH)+ MH==NiO+M + H2O,MH可理解为储氢合金M中吸收结合氢原子,下列说法不正确的是

A. MH电极是负极
B. OH-向MH极移动
C. 正极电极反应式:NiO(OH)+e-=NiO+OH-
D. 电子从MH电极流向NiO(OH)电极,经KOH溶液流回MH极
【答案】D
【解析】A、根据反应原理,负极上失电子,化合价升高,即MH电极为负极,故A说法正确;B、根据原电池的工作原理,阴离子向负极移动,即OH-移向MH极,故B说法正确;C、电解质为KOH,根据反应原理,正极电极反应式为NiO(OH)+e-=NiO+OH-,故C说法正确;D、根据原电池的工作原理,电子从负极经外电路流向正极,电解质溶液中只有阴阳离子的移动,故D说法错误。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾霾天气的主要成因之一。
i.在汽车排气管加装催化转化器,可有效降低污染物的浓度,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,
N2(g)+2CO2(g)△H<0。为了模拟催化转化器的工作原理,在t℃时,将2molNO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量变化如图所示,

(1)①则反应进行到20min时,CO2的平均反应速率为________________.
②28min~36min内NO、CO、N2的物质的量发生了变化(NO、CO图像未画出),引起该变化的条件可能是______.
a.加入催化剂 b.通入0.2mol N2
c.缩小容器体积 d.增加CO2的物质的量
③当36min达到平衡后,若保持体系温度为t℃,再向容器中充入CO、CO2气体,使两者物质的量浓度均加倍,平衡将__________移动(填“向左”、“向右”或“不”)
(2)若均取2molNO和1molCO的混合气体分别放入3种不同的容器中进行该反应,A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是______.
a.3个容器中NO的平衡转化率的大小顺序为 aA>aB>aC.
b.当A容器内气体的平均摩尔质量不变时,说明该反应处于化学平衡状态
c.A、B两个容器达到平衡所用的时间:tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
ii. 某温度下,NO2(g)+SO2(g)SO3(g)+NO(g)的平衡常数K=![]() ,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/molL﹣1 | 0.10 | 0.20 | 0.20 |
c(SO2)/molL﹣1 | 0.10 | 0.10 | 0.20 |
(3)①10min后,甲中达到平衡,则甲中NO2的转化率α(NO2)=_______________.
②达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为_____________.
(4)利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。

电极b的电极反应式为__________________;常温下,若用该电池电解0.6L饱和食盐水,消耗标准状况下448mL NH3时, 发现两极产生相同体积的气体,则此时溶液的PH=____(假设电解过程溶液体积不变)。