题目内容
【题目】某工厂用废铜铁合金制取生产油漆的颜料铁红(Fe2O3),并回收铜的流程如下:
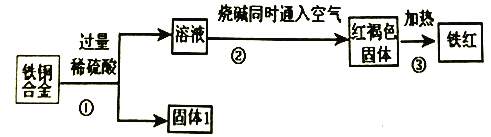
完成下列问题:
(1)上述三个过程中发生了氧化还原反应的是____________(填符号①②③)。
(2)固体1的名称______;红褐色固体的化学式______ 。
(3)写出整个②过程发生反应的离子方程式:______ ;______ ;______ 。
【答案】 ①② 铜 Fe(OH)3 H++OH-=H2O Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+2H2O+O2= 4Fe(OH)3
【解析】废铜铁合金与过量的稀硫酸反应时铁溶解,铜不反应,固体1是铜。溶液中含有硫酸亚铁和硫酸,加入烧碱同时通入空气生成红褐色氢氧化铁沉淀,加热分解生成氧化铁,即制得铁红。
(1)氢氧化铁分解不是氧化还原反应,则上述三个过程中发生了氧化还原反应的是①②。(2)根据以上分析可知固体1的名称铜;红褐色固体是氢氧化铁,化学式为Fe(OH)3。(3)溶液中含有硫酸,首先发生中和反应,然后亚铁离子与氢氧根反应生成氢氧化亚铁沉淀,最后是氢氧化亚铁被氧化为氢氧化铁,则整个②过程发生反应的离子方程式为H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2=4Fe(OH)3。

【题目】已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/c2(CH3OH),该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44。请回答下列问题:
(1)写出上述反应的化学方程式:_________________________________ 。
(2)该反应的△H _________0。
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度/(molL-1) | 0.54 | 0.68 | 0.68 |
①此时温度400℃,则某时刻υ正_______υ逆(填<、>或=,下同)。
②若以温度为横坐标,以该温度下平衡态甲醇物质的量n为纵坐标,此时反应点在图象的位置是图中____点,比较图中B、D两点所对应的正反应速率υB_______υD,理由是____。

(4)一定条件下要提高反应物的转化率,可以采用的措施是___________。
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物


