题目内容
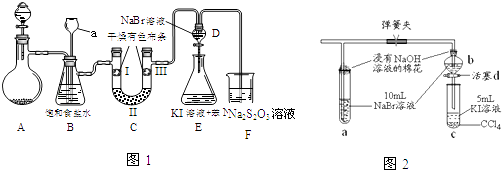
【题目】某同学将Fe+2FeCl3=3FeCl2设计成原电池装置如图所示.下列说法正确的是( ) 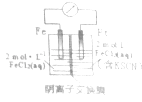
A.电子由铁极经溶液向铂极迁移
B.放电过程中交换膜右侧溶液颜色逐渐变浅
C.正极的电极反应式为Fe3++3e﹣=Fe
D.若转移2mole﹣ , 交换膜右侧溶液中约减少3mol离子
【答案】B
【解析】解:A、电子不能从溶液中转移,故A错误;B、Fe3+在正极得到电子而被还原,Fe3+浓度减小,左侧溶液中铁离子不能通过阴离子交换膜,所以右侧溶液颜色变浅,故B正确;
C、正极电极反应式为Fe3++e﹣=Fe2+ , 故C错误;
D、右侧为正极,电极反应式为Fe3++e﹣=Fe2+ , 所以转移2mole﹣ , 交换膜右侧溶液中约减少2mol离子,故D错误;
故选B.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.可用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)═N2(g)+CO2(g)△H=QkJmol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
0~10min内,CO2的平均反应速率v(CO2)= , 反应进行到30min时,NO 的转化率= .
【题目】下表对某些反应方程式的评价合理的是( )
编号 | 离子方程式或电极反应式 | 评价 | |
A | 次氯酸钙溶液中通入足量SO2 | Ca2++ClO﹣+SO2+H2O=CaSO4+Cl﹣+2H+ | 正确 |
B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO | 正确 |
C | 醋酸铵溶于水 | CH3COO﹣+NH | 错误,阴离子水解相互促进,应该用“=”号 |
D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e﹣=2Cu | 错误,该阴阳两极反应不可能同时发生 |
A.A
B.B
C.C
D.D