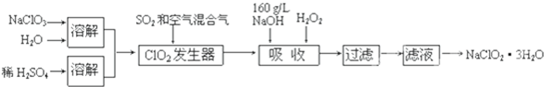
��Ŀ����
����������������CN-�ķ�ˮ�����У�Һ���ڼ��������¿��Խ��軯�������������Σ��䶾��Ϊ�軯���ǧ��֮һ���������ν�һ����������Ϊ�����ʡ�?��1��ij����ˮ�к�KCN����Ũ��Ϊ650 mg��L-1���������������������������·�Ӧ������N�Ļ��ϼ�Ϊ-3����KCN+2KOH+Cl2![]() KOCN+2KCl+H2O
KOCN+2KCl+H2O
��������Ԫ��Ϊ ��
��2��Ͷ�������Һ�ȣ��ɽ������ν�һ������Ϊ�����ȶ����ʡ��ں�������д���ɵ����ȶ����ʣ��ڷ�������д��ƽ��ѧ��������
![]()
��3��������������ˮ20.0 L��ʹKCN��ȫת��Ϊ�����ʣ�������Һ�� g��
��1��̼����C��?
��2��2KOCN+4KOH+3Cl2![]() 6KCl+2CO2��+N2��+2H2O?
6KCl+2CO2��+N2��+2H2O?
��3��35.5?
��������1��![]() N+2KOH+Cl2
N+2KOH+Cl2![]() KO
KO![]() N+2KCl+H2O���ݻ��ϼ����߱��������Ϊ̼��?
N+2KCl+H2O���ݻ��ϼ����߱��������Ϊ̼��?
��2��C��N��Ϊ���ȶ������ʿ��ƶϲ���ΪCO2��N2�����غ����ƽ��?
![]()
��3��ʹKCN��ȫת��Ϊ�����ʣ��ݹ�ϵʽ���ڣ�1��ʽ��KCN��Cl2����KOCN���ڣ�2��ʽ��2KOCN��3Cl2�����ܹ�ϵʽ��
2KCN������������������5Cl2?
2��
?x=35.5

��ϰ��ϵ�д�
�����Ŀ