题目内容
8.化学与生产生活密切相关.下列说法正确的是( )| A. | 碳酸钡可用于治疗胃酸过多的药 | |
| B. | 二氧化硫可用作食品的漂白剂 | |
| C. | 碳纤维是复合材料 | |
| D. | PM2.5指数是雾霾天气监测中的重要指标 |
分析 A.碳酸钡与盐酸反应生成氯化钡和二氧化碳和水;
B.二氧化硫有毒;
C.根据复合材料是把多种材料复合在一起得到的一种具有特别性能的材料解答;
D.造成雾霾天气的原因之一是空气中的PM2.5(属于可吸入颗粒物)的增加.
解答 解:A.碳酸钡与盐酸反应生成氯化钡和二氧化碳和水,钡离子为重金属离子,有毒,故A错误;
B.二氧化硫有毒,不能用作食品漂白剂,故B错误;
C.碳纤维是由碳和纤维复合而成的,属于复合材料,故C正确;
D.造成雾霾天气的原因之一是空气中的PM2.5(属于可吸入颗粒物)的增加,PM2.5指数是雾霾天气监测中的指标,故D正确;
故选:CD.
点评 本题考查了常见元素的及其化合物的性质和用途,明确相关化合物的性质是解答本题的关键,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
18.下列说法或表示方法正确的是( )
| A. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol |
19.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-=Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+=CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-=CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-=H2O 2KOH+H2SO4═K2SO4+2H2O |
3.下列对化学反应预测正确的是( )
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)═X(g)+Y(s) | △H>0 | 它是非自发反应 |
| B | W(s)+xG(g)═20Q(g) | △H<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g)+5Y(g)═4W(g)+6G(g) | 能自发反应 | △H一定小于0 |
| D | 4M(s)+N(g)+2W(l)═4Q(s) | 常温下,自发进行 | △H>0 |
| A. | A | B. | B | C. | C | D. | D |
13.已知PCl5是三角双锥几何构型,若Cl元素有两种稳定的同位素,则PCl5的不同分子种数(包括异构体)为( )
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
9.反应I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$常用于精盐中碘含量测定.
(1)某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择②③④(填序号).
①1mL 0.01mol•L-1的碘水 ②1mL 0.001mol•L-1的碘水 ③4mL 0.01mol•L-1的Na2S2O3溶液 ④4mL 0.001mol•L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O${\;}_{3}^{2-}$)=8.33×10-4mol/(L•s).
(3)所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,200℃时,该反应的平衡常数为$\frac{1}{2.25}$,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol
•L-1)变化如表:
①请计算5min时H2O的平衡浓度0.006mol/L.
②CO的平衡转化率为40%.
③若5min~10min只改变了某一条件,该条件是增大水蒸气的浓度,如何改变的增大0.01mol/L.
(1)某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择②③④(填序号).
①1mL 0.01mol•L-1的碘水 ②1mL 0.001mol•L-1的碘水 ③4mL 0.01mol•L-1的Na2S2O3溶液 ④4mL 0.001mol•L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O${\;}_{3}^{2-}$)=8.33×10-4mol/(L•s).
(3)所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,200℃时,该反应的平衡常数为$\frac{1}{2.25}$,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol
•L-1)变化如表:
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
②CO的平衡转化率为40%.
③若5min~10min只改变了某一条件,该条件是增大水蒸气的浓度,如何改变的增大0.01mol/L.
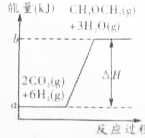 ,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:
,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应: