题目内容
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题
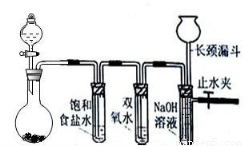
A B C D
(1)试管B中饱和食盐水的作用 ;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是 ;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为 ,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有 (用化学方程式表示),对于质疑可以采用对比实验来解决。
(1)除去Cl2中混有的HCl;(2)Cl2+H2O2=2HCl+O2;(3)吸收多余的Cl2;(4)试管D中液面下降,长颈漏斗中液面上升;该气体能使带火星的木条复燃,证明是氧气;(5)2H2O2=2H2O+O2↑;Cl2+H2O=HCl+HClO ;2HClO=2HCl+O2↑。
【解析】
试题分析:(1)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,故饱和食盐水的作用是除去Cl2中混有的HCl;(2)Cl2氧化能力强于H2O2,能将H2O2氧化产生O2,化学方程式Cl2+H2O2=2HCl+O2(3)有少量的Cl2没有发生反应排出,用NaOH溶液吸收多余的Cl2(4)将浓盐酸注入圆底烧瓶后产生大量的氯气,后与双氧水反应生成大量的氧气,D中装置中空气排今后止水夹关闭,D装置内压强增大使液面下降,长颈漏斗中液面上升;检验氧气的方法,使带火星的木条复燃(5)2H2O2=2H2O+O2↑;Cl2+H2O=HCl+HClO,2HClO=2HCl+O2↑。
考点:氯气的实验室制法;氧化性强弱的比较;氧气的检验方法

 阅读快车系列答案
阅读快车系列答案