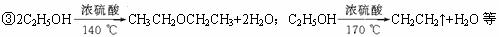题目内容
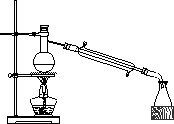
溴乙烷是重要的化工原料,实验室制取 溴乙烷(沸点38.4℃)的原理及步骤如下:(1)反应原理
C2H5OH+NaBr+H2SO4
 NaHSO4+C2H5Br+H2O
NaHSO4+C2H5Br+H2O(2)主要装置
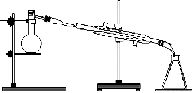
(3)操作步骤
①在100mL圆底烧瓶中加入研细的13g溴化钠,然后加入28mL78%硫酸、10mL95%乙醇,②加入几粒碎瓷片,小心摇动烧瓶使其均匀,将烧瓶与直形冷凝管相连,冷凝管下端连接接收器;③小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷流出为止;④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?____________________________________________。
②亚硫酸钠溶液的作用是________________。
③该实验中会产生许多生成有机物的副反应,写出化学方程式:________________________(举一例)。
④本次实验只收集到5mL溴乙烷,比理想产量约10mL少,可能是溴乙烷易挥发的缘故,应采取什么措施减少其损失?_______________________________。
①浓硫酸有强氧化性会将溴离子氧化为单质溴
②除去溴乙烷中的溴并溶解其中的乙醇
③2C2H5OH
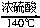 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O④将烧瓶放在冰水中冷却、开始时应先缓缓加热较长一段时间,然后再蒸馏、洗涤时也要把锥形瓶放在冰水中
【试题分析】

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目