��Ŀ����
��ѧ��һֱ�����о����¡���ѹ�¡��˹�Χ�������·���������ʵ�鱨�����ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����һ���о�NH3���������¶ȵĹ�ϵ������ʵ�����ݼ��±������ա�N2ѹ��1.0��105Pa����Ӧʱ��3 h��:
| T/K | 303 | 313 | 323 | 353 |
| NH3������/��10-6mol�� | 4��8 | 5��9 | 6��0 | 2��0 |
��Ӧ���Ȼ�ѧ����ʽ���£�
��N2(g)+3H2O(1)=2NH3(g)+![]() O2(g) ��H=+765.2kJ��mol-1
O2(g) ��H=+765.2kJ��mol-1
�ش��������⣺
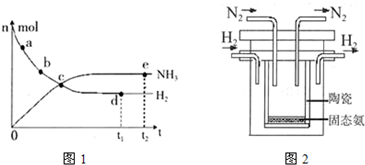
��1�����ڴ��������ͼ�л���������Ӧ���д�����������������·�Ӧ����
����ϵ�����仯ʾ��ͼ�������б�Ҫ��ע��
��2����Ŀǰ�㷺ʹ�õĹ�ҵ�ϳɰ�������ȣ��÷����й̵���Ӧ�����������������
���䷴Ӧ����������NH3�������Ľ��飺�� ��������
��3����ҵ�ϳɰ��ķ�ӦΪN2(g)+3H2(g)![]() 2NH3(g)�������ݻ�Ϊ2.0L���ܱ������г���0.60mol N2(g)��1.60 mol H2(g),.��Ӧ��һ�������´ﵽƽ��ʱ��NH3�����ʵ���������NH2�����ʵ����뷴Ӧ��ϵ���ܵ����ʵ���֮�ȣ�Ϊ
2NH3(g)�������ݻ�Ϊ2.0L���ܱ������г���0.60mol N2(g)��1.60 mol H2(g),.��Ӧ��һ�������´ﵽƽ��ʱ��NH3�����ʵ���������NH2�����ʵ����뷴Ӧ��ϵ���ܵ����ʵ���֮�ȣ�Ϊ![]() ������
������
�ٸ�������N2��ƽ��ת���ʣ�
�ڸ������·�Ӧ2NH3(g) ![]() N2(g)+3H2(g)��ƽ�ⳣ����
N2(g)+3H2(g)��ƽ�ⳣ����
��1����ͼ��
��2�������¶ȣ�����Ӧ��N2��Ũ�ȣ������Ƴ����������뷴Ӧ��ϵ��
��3���ٸ�������N2��ƽ��ת���ʣ�66.7%
�ڸ������·�Ӧ2NH3(g) ==== N2(g) +3H2(g)��ƽ�ⳣ��Ϊ0.005
����:
��1��Ҫ�㣺
1.�����ɽ��ͷ�Ӧ�Ļ�ܣ����������Ӧǰ�������仯���������κ�Ӱ�졣
2.�÷�ӦΪ���ȷ�Ӧ�����Է�Ӧ���������Ҫ�������������������
��2���÷�Ӧ����Ӧ�����ȷ�Ӧ�������¶ȣ�ʹ��ѧƽ��������Ӧ�����ƶ����Ӷ�����NH3�������������¶�Ҳ����߷�Ӧ���ʣ�����ӦN2Ũ�ȣ��ӿ췴Ӧ���ʣ���ʹ��ѧƽ�������ƶ��������Ƴ����������뷴Ӧ��ϵ��ʹƽ�������ƶ�������NH3��������
��3��������ʽ�������֪����ʼʱ��c(N2)=0.3mol/l.ƽ��ʱ��c(N2)=0.1mol/l��c(H2)=0.2mol/l; c(NH3)=0.4mol/l ��
������N2��ƽ��ת����=(0.3-0.1)/0.3*100%=66.7%
�ڷ�Ӧ2NH3(g) ==== N2(g) +3H2(g)��ƽ�ⳣ��K= c(N2)* c(H2)^3/ c(NH3)^2=0.005

(7��) ��ѧ��һֱ�����ڡ��˹��̵����ķ����о���
��Ŀǰ�ϳɰ��ļ���ԭ��Ϊ��
�÷�Ӧ�������仯��ͼ��ʾ��
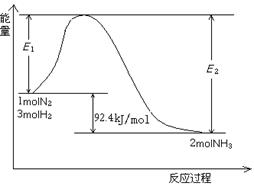
���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�ǣ� �������������С�����䡱����
�ڽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
������ߢ�������H2��ת���ʣ����д�ʩ���е��� ��
A���������а�ԭ�����ٳ���ԭ���� B�����������ٳ����������
C���ı䷴Ӧ�Ĵ��� D��Һ��������������
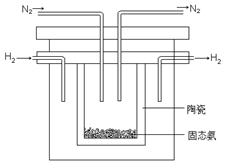
��1998��ϣ������ʿ��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+�����Ӷ�ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ�����ʵ��װ����ͼ��ʾ�������ĵ缫��ӦʽΪ ��
�Ǹ������¡��˹��̵������о��������ڳ��¡��� ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��
��һ���о�NH3���������¶ȹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
|
T/K |
303 |
313 |
323 |
|
NH3������/��10��6mol�� |
4.8 |
5.9 |
6.0 |
�ٺϳɷ�Ӧ��a_ 0��������ڡ�����С�ڡ����ڡ���
����֪

��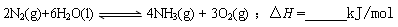
��14�֣�
��ѧ��һֱ�����ڡ��˹��̵����ķ����о���
��Ŀǰ�ϳɰ��ļ���ԭ��Ϊ��
�÷�Ӧ�������仯��ͼ��ʾ��

���ڷ�Ӧ��ϵ�м����������Ӧ��������E2�ı仯�ǣ� �������������С�����䡱����
�ڽ�һ������N2(g)��H2(g)����1L���ܱ������У���500�桢2��107Pa�´ﵽƽ�⣬���N2Ϊ0.1 mol��H2Ϊ0.3 mol��NH3Ϊ0.1 mol����������H2��ת����Ϊ ��
������ߢ�������H2��ת���ʣ����д�ʩ���е��� ��
A���������а�ԭ�����ٳ���ԭ����
B�����������ٳ����������
C���ı䷴Ӧ�Ĵ���
D��Һ��������������
��1998��ϣ������ʿ��´�ѧ����λ��ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+�����Ӷ�ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ�����ʵ��װ����ͼ��ʾ�������ĵ缫��ӦʽΪ ��

�Ǹ������¡��˹��̵������о��������ڳ��¡��� ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��

��һ���о�NH3���������¶ȹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������£�
|
T/K |
303 |
313 |
323 |
|
NH3������/��10��6mol�� |
4.8 |
5.9 |
6.0 |
�ٴ˺ϳɷ�Ӧ��a_ 0��������ڡ�����С�ڡ����ڡ���
����֪

�� NH4Cl��Һ�����ԣ���������NH ˮ���Ե�ʡ���NH4Cl����ˮ��D2O����ˮ������ӷ���ʽ��
��
ˮ���Ե�ʡ���NH4Cl����ˮ��D2O����ˮ������ӷ���ʽ��
��
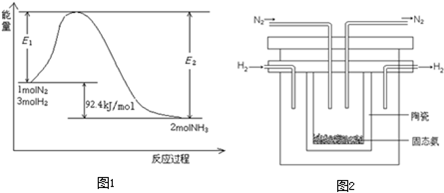
 2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
 2H+���������ĵ缫��ӦΪ��_____________��
2H+���������ĵ缫��ӦΪ��_____________��