题目内容
同周期的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性强弱顺序是:
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是
| A.原子半径 X>Y>Z | B.原子序数 X>Y>Z |
| C.气态氢化物稳定性 X<Y<Z | D.元素的非金属性 X<Y<Z |
B
非金属性越强,相应最高价氧化物的水化物的酸性就越强。同周期元素自左向右原子半径逐渐增大,金属性逐渐减弱,非金属性逐渐增强,根据题意可知非金属性是,所以原子序数是X>Y>Z,原子半径是X<Y<Z。非金属性越强,氢化物的稳定性就越强,所以正确的答案是B。

练习册系列答案
相关题目
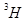 2O和
2O和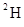 2O
2O