题目内容
15.有A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物,组成单质E的元素是常见金属元素,位于元素周期表第4周期,该元素可与D形成ED2和ED3两种化合物,回答下列问题.(1)A2B2中的化学键类型共价键.
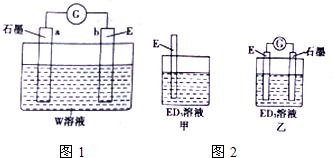
(2)CB2通入A2B2溶液中可被氧化为W,用E、石墨和W的溶液组装成原电池(如图1所示),其中,E做负极(填“正”或“负”),该电极发生氧化反应(填“氧化”或“还原”),石墨电极上观察到的现象有气泡产生.
(3)若按如图2装置进行实验,甲、乙装置中观察到的相同的实验现象为铁棒变细,溶液由黄色逐渐变为浅绿色.
分析 A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D为Cl元素;组成单质E的元素是常见金属元素,位于元素周期表第4周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素.
(1)H2O2属于共价化合物;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,Fe、硫酸、石墨组成原电池,Fe发生氧化反应生成亚铁离子,作负极,石墨为正极,氢离子在正极获得电子生成氢气;
(3)甲中Fe与氯化铁反应生成氯化亚铁,乙中石墨、铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,均发生反应:2Fe3++Fe=3Fe2+.
解答 解:A、B、C、D四种短周期主族元素,其原子序数依次增大,A、B可形成A2B和A2B2两种化合物,可能为H2O、H2O2或Na2O、Na2O2,则A为H元素,B为O元素,B、C同主族且可形成CB2和CB3两种化合物,应为SO2和SO3,则C为S元素,D为Cl元素;组成单质E的元素是常见金属元素,位于元素周期表第4周期,该元素可与D形成ED2和ED3两种化合物,则E为Fe元素.
(1)H2O2属于共价化合物,含有共价键,故答案为:共价键;
(2)SO2通入H2O2溶液中可被氧化为W,则W为H2SO4,Fe、硫酸、石墨组成原电池,Fe发生氧化反应生成亚铁离子,作负极,石墨为正极,氢离子在正极获得电子生成氢气,现象为:有气泡产生,故答案为:负;氧化;有气泡产生;
(3)甲中Fe与氯化铁反应生成氯化亚铁,乙中石墨、铁在氯化铁电解质溶液中形成原电池,石墨为正极,Fe3+在正极获得电子生成Fe2+,Fe为负极,发生氧化反应生成Fe2+,均发生反应:2Fe3++Fe=3Fe2+,二者共存现象为:铁棒变细,溶液由黄色逐渐变为浅绿色,故答案为:铁棒变细,溶液由黄色逐渐变为浅绿色.
点评 本题考查结构性质位置关系应用,侧重对原电池的考查,正确推断元素的种类为解答该题的关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4)n(水层)+2n HA(有机层)?2RAn(有机层)+n H2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
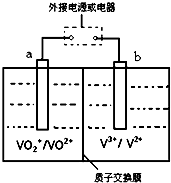
①全矾液流电池的工作原理为:VO2++V2++2H+ $?_{()电}^{()电}$VO2++H2O+V3+(请在可逆符号两侧的括号中填“充”、“放”)此时,b极接直流电源负极.
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O,当转移1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”).
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |
| A. | NH4是氨气的分子式 | B. |  是Cl-的结构示意图 是Cl-的结构示意图 | ||
| C. | C2H4是乙烯的结构简式 | D. |  是氯化钠的电子式 是氯化钠的电子式 |
| A. | SO2,SiO2,Al2O3均为酸性氧化物 | B. | 稀豆浆,雾,氯化铁溶液均为胶体 | ||
| C. | 漂白粉,水玻璃,氨水均为混合物 | D. | 烧碱,冰醋酸,乙醇均为电解质 |
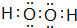 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”). (1)为达到相关实验目的,有如下操作,但其中有的正确,有的却因用错试剂,或加入试剂的顺序错误等原因而导致实验失败.请用下列选项的字母代号填空.
(1)为达到相关实验目的,有如下操作,但其中有的正确,有的却因用错试剂,或加入试剂的顺序错误等原因而导致实验失败.请用下列选项的字母代号填空.