题目内容
(8分)淡黄色固体A和气体X存在如下转化关系:

请回答下列问题
(1)反应③的化学方程式为 。
(2)写出反应②④的离子方程式:反应② 。
反应④ 。
(4)检验溶液C中的主要阴离子的实验操作为_________ ________。

请回答下列问题
(1)反应③的化学方程式为 。
(2)写出反应②④的离子方程式:反应② 。
反应④ 。
(4)检验溶液C中的主要阴离子的实验操作为_________ ________。
(8分)(1)2Na + O2 Na2O2(2分)
Na2O2(2分)
(2)Ca2++CO32-= CaCO3↓ (2分) CaCO3 + 2H+=Ca2+ + H2O + CO2↑(2分)
(3)取适量溶液C于一洁净试管中,滴加AgNO3溶液,产生白色沉淀,加入稀HNO3,白色沉淀不消失,证明是Cl-(2分)
 Na2O2(2分)
Na2O2(2分) (2)Ca2++CO32-= CaCO3↓ (2分) CaCO3 + 2H+=Ca2+ + H2O + CO2↑(2分)
(3)取适量溶液C于一洁净试管中,滴加AgNO3溶液,产生白色沉淀,加入稀HNO3,白色沉淀不消失,证明是Cl-(2分)
考查钠及其化合物的性质
在高中化学范畴内,淡黄色固体A和气体X只能为过氧化钠与CO2:2Na2O2+2CO2=2Na2CO3+O2↑,气体B为氧气,而Y为Na2CO3:Na2CO3+CaCl2=CaCO3↓+2NaCl;
白色沉淀D为碳酸钙,可与盐酸生成CO2:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
氧气B与钠可生成过氧化钠:2Na + O2 Na2O2
Na2O2
在高中化学范畴内,淡黄色固体A和气体X只能为过氧化钠与CO2:2Na2O2+2CO2=2Na2CO3+O2↑,气体B为氧气,而Y为Na2CO3:Na2CO3+CaCl2=CaCO3↓+2NaCl;
白色沉淀D为碳酸钙,可与盐酸生成CO2:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
氧气B与钠可生成过氧化钠:2Na + O2
 Na2O2
Na2O2
练习册系列答案
相关题目

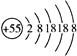 ,该元素在周期表中的位置是
,该元素在周期表中的位置是

 为
为