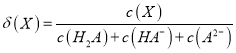题目内容
【题目】某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
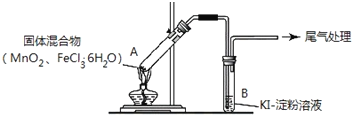
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)实验前要首先进行的操作是____________.
(2)现象Ⅰ中白雾的成分是_________(填名称),形成白雾的原因是________.
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______.
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象:B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________。
【答案】 检查装置的气密性 盐酸或氯化氢 加热时FeCl3·6H2O 发生水解反应产生HCl,挥发出来遇到水蒸气形成白雾 FeCl3 2Fe3++2I-=I2+2Fe2+ 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ 通过未检测出Fe2+,说明Cl2将Br氧化为Br2,而Fe3+不能,证明黄色气体中一定含有Cl2
【解析】(1)实验中有气体产生,故在实验前要检查装置的气密性。
(2)FeCl3·6H2O加热分解生成水,FeCl3发生水解反应,加热下水解程度增大,产生HCl气体,HCl气体在上方遇到水蒸气形成盐酸小液滴即白雾。故答案为:盐酸或氯化氢、加热时FeCl3·6H2O 发生水解反应产生HCl,挥发出来遇到水蒸气形成白雾。
(3)黄色气体通入KSCN溶液,溶液变红,说明黄色气体中含有Fe3+,故黄色气体中还含有升华出的FeCl3;Fe3+具有氧化性,能将I-氧化为I2单质,从而淀粉变蓝色,对应的离子方程式为:2Fe3++2I-=I2+2Fe2+。
(4)a、铁氰化钾溶液与Fe2+反应生成蓝色沉淀,其原理的离子方程式为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ ; b、黄色气体中一定含有FeCl3,未检测出Fe2+,说明Fe3+不能将Br-氧化,而溶液呈浅橙红色,说明生成了Br2单质,则黄色气体中一定含有Cl2。故答案为:通过未检测出Fe2+,说明Cl2将Br氧化为Br2,而Fe3+不能,证明黄色气体中一定含有Cl2。

 阅读快车系列答案
阅读快车系列答案【题目】设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究:
实验一:检验氢氧化钠溶液中是否含有氢氧化钙。
(分析)从组成上看,氢氧化钙和氢氧化钠都属于碱,它们在水溶液中都能解离出相同的_______(填符号),所以具有相似的化学性质。但由于解离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能解离出CO32﹣的试剂利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。
(设计方案并实验)
实验操作 | 现象 | 结论 | |
方案一 | 取少量待测溶液于试管中,通入CO2 | 出现白色沉淀 | 氢氧化钠溶液中含有氢氧化钙 |
方案二 | 取少量待测溶液于试管中,滴加 _________溶液 | 出现白色沉淀 |
写出上述方案中出现白色沉淀的一个化学方程式__________________________________________。
(方法感悟)在检验物质时,要分析物质的组成和______。据此选择加入恰当的试剂,最后根据不同现象得出结论。
(实验探究)实验二:有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如下实验:
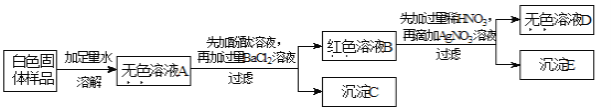
(1)上述实验中,过滤操作用到的玻璃仪器有:烧杯、玻璃棒和_________。
(2)小晶同学通过上述实验推知:白色固体样品中一定不含有_________。(填化学式)
(3)为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验。
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量 _________。 | 有气泡产生,沉淀全部消失。 | 白色固体样品中一定含有 ________。 |
(4)小虎同学认为白色固体中还要物质不能确认其是否存在.其理由是:_________________。
(用化学方程式表示)如要确认,只需将上述实验方案中所加的一种试剂改为_______即可。
(方法感悟)若其他物质的存在对所检验的物质有干扰时,可先将干扰物质转化,再选择加入恰当的试剂,最后根据不同现象得出结论。
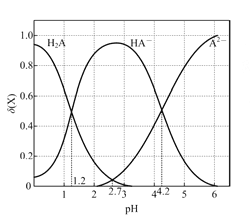
【题目】在一定温度下,将气体X和气体Y各0.32mol充入10L恒容密闭容器中,发生反应x(g)+ Y(g) ![]() 2Z(g)AH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g)AH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.24 | 0.22 | 0.20 | 0.20 |
下列说法正确的是( )
A. 反应前2min 的平均速率 v(Z)=4.0×10-3mol/(L·min)
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数k=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数减小