题目内容
(12分)①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:

(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。

(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
(1)Na HClO4 NaOH Al(OH)3 Na H+
(2)第三周期第IA;2Na+O2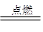 Na2O2
Na2O2
(3)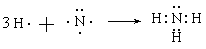
(2)第三周期第IA;2Na+O2
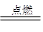 Na2O2
Na2O2(3)
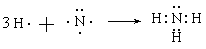
考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可知①~⑩分别是H、C、N、Na、Mg、Al、Si、P、S、Cl。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。金属性越强最高价氧化物的水化物的碱性越强。非金属性越强,最高价氧化物的水化物的酸性越强,氢化物的稳定性越强。钠的燃烧产物是过氧化钠,氨气是由极性键构成的共价化合物。

练习册系列答案
相关题目
 进入大气。
进入大气。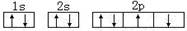 ,该排布图违背了泡利原理
,该排布图违背了泡利原理