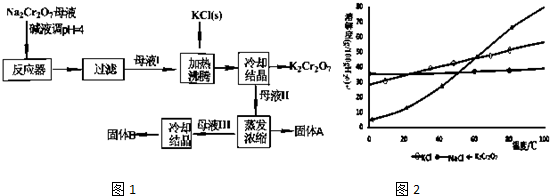
题目内容
10.下列有关钠、铁、铝性质的说法中正确的是( )| A. | 在地壳中的含量:Fe>Al>Na | |
| B. | 均能与盐酸反应,生成物中金属价态数值:Al>Fe>Na | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁 | |
| D. | 等质量的三种金属与足量盐酸反应时,钠置换出的氢气最多 |
分析 A、根据地壳中的含量多少判断;
B、根据钠、铁、铝性质其中钠最活泼分析;
C、钠与FeCl3溶液先与水反应生成氢氧化钠,氢氧化钠与氯化铁反应生成氢氧化铁的沉淀;
D、依据钠铝铁和酸反应的定量关系计算分析,2Na~H2 ,2Al~3H2,Fe~H2,依据电子守恒判断生成氢气多少.
解答 解:A、因为地壳中的含量前几位的是O,Si,Al,Fe,Ca,所以地壳中的含量为Al>Fe>Na,故A错误;
B、因为钠、铁、铝性质中钠最活泼,所以与盐酸反应,金属钠与盐酸的反应最剧烈,故B正确;
C、钠与FeCl3溶液先与水反应生成氢氧化钠,氢氧化钠与氯化铁反应生成氢氧化铁的沉淀,所以钠不能从FeCl3溶液中置换出铁单质,故C错误;
D、等质量的三种金属与足量盐酸反应时,
2Na~H2 ,电子转移$\frac{1}{23}$,2Al~3H2,电子转移$\frac{1}{27}$×3=$\frac{1}{9}$,Fe~H2 电子转移$\frac{1}{56}$×2=$\frac{1}{28}$,铝置换出的氢气最多,故D错误.
故选B.
点评 本题主要考查了元素及其化合物知识,难度中等,根据所学知识即可完成,掌握基础是关键.

练习册系列答案
相关题目
1.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 16g CH4与18 g NH4+所含质子数相等 | |
| B. | 0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L | |
| D. | 7.8 g Na2O2中含有的离子总数目为0.3NA |
15.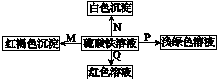 是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
 是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )
是物质间发生化学反应时颜色的变化情况,下列选项中正确的是( )| M | N | P | Q | |
| A | NH3•H2O | Ba(OH)2 | 铜 | 石蕊试液 |
| B | Na | BaCl2 | FeO | KSCN |
| C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
| D | NaHCO3 | MgCl2 | Fe | 石蕊试液 |
| A. | A | B. | B | C. | C | D. | D |
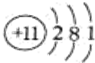 .
.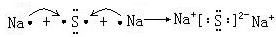 .
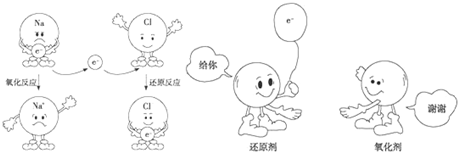
.
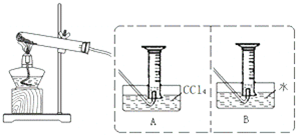 为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习: