题目内容
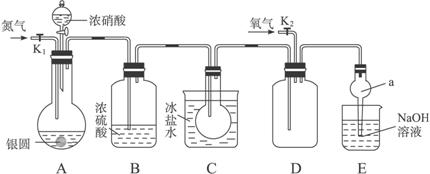
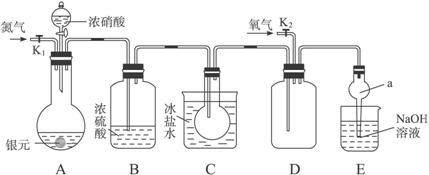
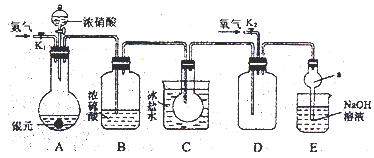
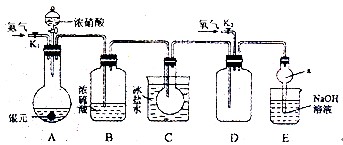
下图为某实验者设计的验证银圆完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0 ℃时,几乎只有无色的N2O4晶体存在。
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是___________________。
(2)若装置中缺B,其后果是_______________________。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色,反应的化学方程式为________________________;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是____________________________________。(用方程式和必要的文字说明)
(4)C装置的作用是_______________________________________________________;
E中a仪器所起的作用是___________________________________________________。
(5)为测定该银圆中银的质量分数,还需进行的主要实验操作是:将A中溶液倒入烧杯中,然后加入过量的NaCl溶液,随后进行的操作为____________(用ABCD字母排序),最后测定溶液中Ag+的质量。
A.洗涤 B.过滤 C.称量 D.烘干
(1)排除装置内的空气,防止生成的NO被空气中的O2氧化
(2)在C中水蒸气被冷却成水,它与NO2或N2O4反应生成NO,干扰NO的验证
(3)2NO+O2![]() 2NO2 2NO2
2NO2 2NO2![]() N2O4(正向放热)升高温度,平衡向左移动,NO2的物质的量增大,颜色加深
N2O4(正向放热)升高温度,平衡向左移动,NO2的物质的量增大,颜色加深
(4)把NO2全部转化为N2O4晶体,避免在D装置中对NO的验证产生干扰 防止倒吸
(5)BADC
解析:A装置为气体发生装置,B装置干燥气体,C装置降低气体温度,使NO2全部转化为N2O4晶体,避免在D装置中对NO的验证产生干扰。E装置吸收尾气,其中a仪器可以防止倒吸。(5)向A中溶液内加入过量NaCl溶液,使Ag+完全转化为AgCl沉淀,随后过滤、洗涤、烘干、称量,从而计算银圆中Ag的质量分数。