题目内容
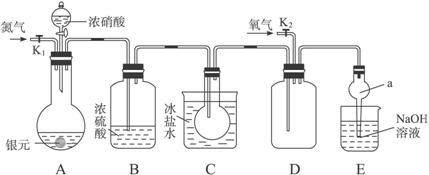
2005年11月,美国科学家们经过研究发现,分布在萤火虫呼吸道上的细胞能够制造一氧化氮,来自大脑的信号则控制释放一氧化氮,一氧化氮致使被称为线粒体的邻近细胞结构短暂地关闭。线粒体关闭时会产生一个氧脉冲,氧脉冲则引发另一细胞中的一种酶打开萤火虫的“灯泡”。整个闪光过程在千分之一秒内即可完成。这次的发现再次验证了一氧化氮在生物机体内的重要作用。下图为某实验者设计的验证银圆完全溶解于一定量的浓硝酸,生成的NO2气体中含有NO的实验装置图。
常温时,NO2与N2O4混合存在;在低于0 ℃时,几乎只有无色N2O4晶体存在。
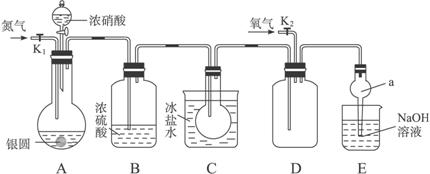
(1)反应前先打开A部分的活塞K1,持续通一段时间N2,其理由是_______________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是_________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是_____________________________
_____________________________________________________________________。
(4)E部分中a仪器所起的作用是_________________________________________________。
(5)已知该银圆的质量为25 g,加入75 mL 12 mol·L-1的浓硝酸。实验结束后,A部分烧瓶内溶液中H+的浓度为2 mol·L-1(反应中HNO3既无挥发也无分解),体积仍为75 mL。
①参加反应的硝酸的物质的量为_________________________。
②为测定该银圆中铜的质量分数,还须进行的主要实验操作是_________________________。
(1)排除系统内的空气,防止生成的NO被空气中的O2氧化
(2)在C中水蒸气被冷却成水,与NO2或N2O4反应,生成NO,干扰NO的验证
(3)2NO+O2====2NO2,气体由无色变为红棕色。升高温度,2NO2![]() N2O4的平衡向左移动,NO2的物质的量增大,颜色加深
N2O4的平衡向左移动,NO2的物质的量增大,颜色加深
(4)防止倒吸
(5)①0.75 mol ②将A中溶液倒入烧杯中,然后加入过量的NaCl溶液,过滤、洗涤、烘干、称量,测定溶液中Ag+的质量,剩余质量为铜的质量
解析:实验者的目的是检验NO2气体中是否混有NO,若实验中途NO发生了转化,就无法确定NO是否在银元宝与硝酸的反应中生成,也就失去了检验的意义。因此第一步操作应排尽装置内的空气,以防NO被装置内的氧气所氧化。
若缺少B装置,则NO2或N2O4则会与C中冷凝后的水反应,生成NO,从而对NO的检验产生干扰。
反应结束后,由于D中存在未反应的NO,所以在导管口因接触空气中的氧气而变红色。升高温度,2NO2![]() N2O4的平衡向左移动,NO2的物质的量增大,颜色加深。
N2O4的平衡向左移动,NO2的物质的量增大,颜色加深。
参加反应的n(HNO3)=(12 mol·L-1-2 mol·L-1)×0.075 L=0.75 mol。
此题中比较难解决的问题是产物中Ag+质量的确定。气体的体积或质量很难测定,所以我们只能测定溶液中金属离子的质量。若加碱,则产物在干燥时会分解,对测定结果造成误差,所以最好是加入Cl-,让Ag+生成沉淀。

 中国青少年网络协会2005年11月在北京发布了我国首部《中国青少年网瘾数据报告》.报告指出,我国100个上网的青少年中有13个上网成瘾.有研究发现,在大脑的相应部位-“奖赏中心”,长时间上网会使“奖赏中心”的化学物质多巴胺水平升高,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
中国青少年网络协会2005年11月在北京发布了我国首部《中国青少年网瘾数据报告》.报告指出,我国100个上网的青少年中有13个上网成瘾.有研究发现,在大脑的相应部位-“奖赏中心”,长时间上网会使“奖赏中心”的化学物质多巴胺水平升高,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图: 可简写为
可简写为