题目内容
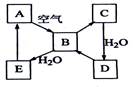
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式 ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10mol·L-1的NaOH溶液混合。
①写出反应的离子方程式 ;
②反应后溶液的pH 7(填“大于”、“小于”或“等于”),理由是 ;
③加热反应后的溶液,其pH (填 “增大”、“不变”或“减小”),理由是
。
(1)S+H2![]() H2S
H2S
(2)H2SO3+2H2S![]() 3S↓+3H2O
3S↓+3H2O
(3)2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O(其他合理答案也可)
CO2↑+2SO2↑+2H2O(其他合理答案也可)
(4)①H2SO3+2OH-![]()
![]() +2H2O
+2H2O
②大于 Na2SO3是弱酸强碱盐,水解后溶液呈碱性
③增大 水解是吸热反应,加热促使![]() 水解程度增大,因而PH增大
水解程度增大,因而PH增大
解析:常见的固体单质除了金属之外还有B、C、Si、P、S、I2,而能在空气中反应生成气体化合物的只有C、S。由A在加热条件下可与氢气反应,便知A是单质硫。从B、C的相对分子质量之比为4∶5,确定A是单质硫,因为SO2和SO3的相对分子质量之比恰为4∶5,硫酸是重要的工业原料,化合物E应为H2SO3。
将5 mL 0.10 mol·L-1的E(H2SO3)溶液与10 mL 0.10 mol·L-1的NaOH溶液混合,二者恰好完全反应,所得为Na2SO3溶液。由于![]() +H2O
+H2O![]()
![]() +OH-,所以溶液显碱性。根据水解的特点可知加热溶液可以促进水解。
+OH-,所以溶液显碱性。根据水解的特点可知加热溶液可以促进水解。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案