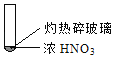题目内容
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A、B两仪器的名称:A________,B________。
(2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入下列溶液中的C______________,D______________。
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是__________________。
(4)G是浸有淀粉KI溶液的棉花球,该反应的离子方程式是_______________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成________。
(5)P为尾气吸收装置,写出实验室吸收氯气的反应的离子方程式_______________。
【答案】 分液漏斗 圆底烧瓶 ② ④ E中红色布条不变色,F中红色布条褪色 Cl2+2 I-=2 Cl-+I2 橙色或橙黄 Cl2+2OH-=Cl-+ ClO-+ H2O
【解析】(1)根据仪器构造可判断A、B两仪器的名称分别是分液漏斗和圆底烧瓶。(2)氯化氢极易溶于水,所以可以利用饱和食盐水除去氯气中的氯化氢。干燥氯气应该用酸性干燥剂,即D中的试剂是浓硫酸。(3)氯气没有漂白性,因此E中红色干布条不褪色;氯气与水反应生成次氯酸具有强氧化性,所以F中红色湿布条褪色。(4)氯气和碘化钾反应的离子方程式是 Cl2+2I-=2Cl-+I2;氯气能把溴化钠氧化为单质溴,所以H处现象是棉花球表面变成橙色或橙黄色。(5)一般用氢氧化钠溶液吸收氯气,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
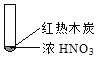
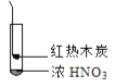
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应