题目内容
某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H2
2NH3达平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是:
①若x=0,y=0,则z= ;
②若x="0.75" mol,则y= ,z= ;
③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一
个含y、z) 。
若将上述条件改为恒温、恒压,其它均不变,则
a.若x=0,y=0,则z= ;
b.若x="0.75" mol,则y= ,z= ;
c.x、y、z取值必须满足的一般条件是 。

2NH3达平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是:
①若x=0,y=0,则z= ;
②若x="0.75" mol,则y= ,z= ;
③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一
个含y、z) 。
若将上述条件改为恒温、恒压,其它均不变,则
a.若x=0,y=0,则z= ;
b.若x="0.75" mol,则y= ,z= ;
c.x、y、z取值必须满足的一般条件是 。
①2mol②y=2.25mol,z=0.5mol
③z=2-2x,z=2-2/3y;a、z>0;b、y=2.25mol,z≥0;c、y=3x,z≥0.
③z=2-2x,z=2-2/3y;a、z>0;b、y=2.25mol,z≥0;c、y=3x,z≥0.
试题分析:①恒温恒容条件下,改变初始物质的加入量,达到平衡时各物质的浓度不变,意味着新平衡与原平衡是等效平衡。对于反应前后气体的物质的量变化的可逆反应而言,两次加入的物质的物质的量完全相同即可达到等效平衡,所以开始充入1mol N2和3 mol H2,相当于充入2mol NH3,则x=0,y=0时,z=2mol;
②同理x=0.75mol,氢气的物质的量是氮气的3倍,则y=2.25mol,此时相当于充入1.5mol的NH3,所以只需再充入0.5mol NH3,即可达到与原平衡等效,即z=0.5mol
③根据①②的数据可得,x、y、z满足的条件是z=2-2x,z=2-2/3y;
若改为恒温恒压条件,则只需加入的物质的物质的量对应成比例即可达到等效平衡。a、若x=0,y=0,则z为任意不为0的数值;b、若x="0.75" mol,开始时氢气的物质的量是氮气的3倍,氨气无论是多少,转化为氮气、氢气时,二者的物质的量之比都是1:3,所以y=2.25mol,z≥0;c、由以上分析可知恒温恒压下,达到与原平衡等效时x、y、z取值必须满足的一般条件是y=3x,z≥0.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为  2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1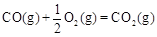 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1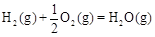 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应)
B(g)+C(g) △H=+85.1kJ·mol-1(吸热反应) 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH 2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是
2SO3(g) △H<0。2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是