题目内容
(1)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。CO2与CS2相比,________的熔点较高。
(2)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有________(填序号),CS2分子的空间构型是________。CO2与CS2相比,________的熔点较高。
(1)非极性 (2)①③ 直线形 CS2
试题分析:(1)CCl4、CS2等均是非极性分子,则根据相似相溶原理可知,CrO2Cl2是非极性分子。
(2)苯、甲醛是平面型结构,碳原子是sp2杂化;甲醇分子和四氯化碳分子中碳原子都是sp3杂化;CS2是直线型结构,碳原子是sp杂化。CO2与CS2相比结构相似,由于CO2的相对分子质量小于CS2的,所以分子间作用力小,则CS2的熔点较高。
点评:该题是高考中的常见题型,试题基础性强,侧重对学生基础知识的训练,旨在提高学生灵活运用基础知识解决实际问题的能力,有利增强学生的学习自信心,提高学生的学习效率和学习积极性。

练习册系列答案
相关题目

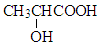 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子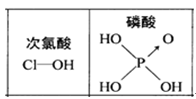
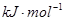 )
)