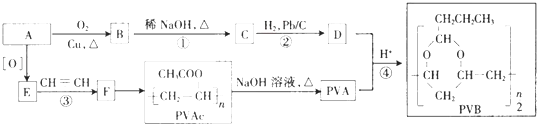
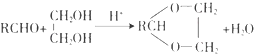题目内容
【题目】某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质Li,Na,Mg,Al组成的合金粉末)进行探究.请完成下列探究报告.
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2molL﹣1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+ . 但Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下.请填写下表.
试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
① | 取少量该焰火原料加入冷水 | 无明显现象 | |
② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体产生,溶液呈无色 |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁.乙的结论(选填“正确”或“错误”),你的理由是 .
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下.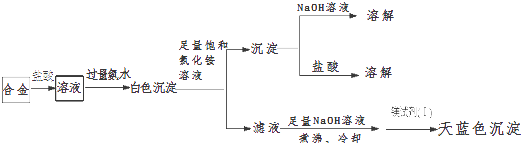
由丙的实验记录可知,该焰火原料是由和两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是 .
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.
问题讨论:
①能确定合金组成的数据组有(填写选项字母);
A.m、n B.m、y C.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线 ;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为
【答案】
(1)不含Li、Na等活泼金属;可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种
(2)错误;由资料知,反应必须在碱性条件下进行
(3)Mg;Al;将NH4+转化为NH3 , 煮沸促进氨气逸出,防止NH4+干扰Mg2+的检验
(4)a、b、c;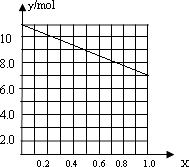 ;Mg4Al3
;Mg4Al3
【解析】解:(1)①原料加入冷水无现象表明不含Li、Na等活泼金属,
所以答案是;不含Li、Na等活泼金属;②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属,可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种;
所以答案是:可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种;(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,由资料知,反应必须在碱性条件下进行;
所以答案是:错误;由资料知,反应必须在碱性条件下进行;(3)由图结合题意知该合金含镁、铝(不溶于足量饱和氯化铵溶液的白色沉淀既能溶液盐酸又能溶液氢氧化钠),由于Mg(OH)2可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg2+时要排除NH4+的干扰,所以滤液加入足量氢氧化钠溶液将NH4+转化为NH3 , 煮沸将氨气赶出,
所以答案是:Mg和Al;将NH4+转化为NH3 , 煮沸促进氨气逸出,防止NH4+干扰Mg2+的检验;(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则a、b、c都可测定合金的组成,
所以答案是:a、b、c;②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁,如x=0,则全被为铝,7mol铝反应生成10.5mol氢气,如全被为镁,即x=7,则生成氢气7mol,则图象为  ,
,
所以答案是:  ;③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则m+n=7 m+1.5n=8.5,解得m=4,n=3,
;③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则m+n=7 m+1.5n=8.5,解得m=4,n=3,
则化学式为Mg4Al3 ,
所以答案是:Mg4Al3 .

【题目】铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图甲,已知:部分物质沉淀的pH如表:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
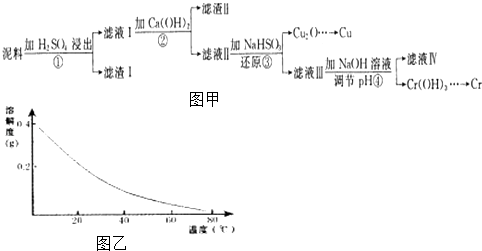
CaSO4的溶解度曲线如图乙,请回答下列问题:
(1)滤液I中所含溶质主要有(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为 , 然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为 .
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1×10﹣5molL﹣1l时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 . (已知Kap[Cr(OH)3]=6.3×10﹣31 , ![]() ≈4.0;lg4=0.6)
≈4.0;lg4=0.6)
(5)Cr(OH)3受热分解为Cr2O3 , 用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式 .