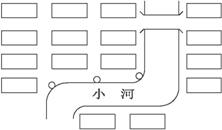
题目内容
| |||||||||||||||||||||||||||||||||||
答案:2.A;3.C;
解析:
解析:
(1) |
答案:+1 氧化性 解析:次氯酸中,H为+1价、O为-2价,因此氯元素的化合价为+1.+1价的氯原子能得到电子而使化合价降低,能得到电子的(或所含元素化合价降低的)物质具有氧化性,由此推知次氯酸具有强氧化性. |
(2) |
由苹果汁的颜色变化,自然联想到离子的特征颜色.显然,这是Fe2+变成Fe3+的过程,故A选项正确. |
(3) |
元素在化合物中的化合价并不确定,化合物中元素的化合价可能高于或低于0价.游离态形式中的元素的化合价为0.因此把某元素由化合态变为游离态时,所含该元素的物质有可能被氧化,也可能被还原,故C选项正确. |

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目