题目内容
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
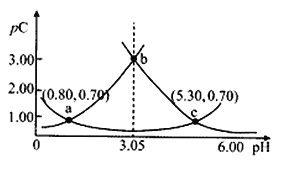
A. 随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B. pH=3. 50 时, c(HA-)>c(A2-)>c(H2A)
C. b点时c(H2A).c(A2-)/c2(HA-)=104.5
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
【答案】B
【解析】
H2AH++HA-,HA-H++A2-,pH增加促进电离平衡正向移动,所以由图可知:下方曲线是HA-的物质的量浓度的负对数,左侧曲线是H2A的物质的量浓度的负对数,右侧曲线是A2-的物质的量浓度的负对数,由此分析解答。
A.由分析可知,随着pH的增大,pC增大的曲线是H2A的物质的量浓度的负对数,故A错误;B.pH=3.50时,左侧曲线是H2A的物质的量浓度的负对数,右侧曲线是A2-的物质的量浓度的负对数,此时pC(H2A)>pC(A2-)>pC(HA-),即c(HA-)>c(A2-)>c(H2A),故B正确;C.b点时,c(H2A)=c(A2-),![]() =
=![]() =
=![]() =
=![]() =10-4.5,故C错误;D.pH=3.00~5.30时,结合物料守恒c(H2A)+c(HA-)+C(A2-)始终不变,故D错误;故答案为B。
=10-4.5,故C错误;D.pH=3.00~5.30时,结合物料守恒c(H2A)+c(HA-)+C(A2-)始终不变,故D错误;故答案为B。

练习册系列答案
相关题目