题目内容
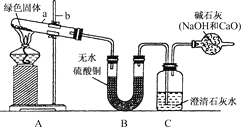
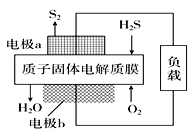
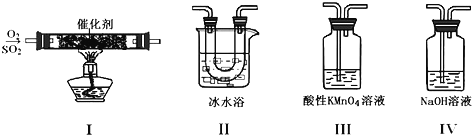
【题目】利用如图所示的装置研究SO2的性质:
已知:
物质 | 熔点℃ | 沸点℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式________________。
(2)甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是___;观察到装置Ⅲ中现象是________________,说明二氧化硫具有___性
(3)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的总的化学方程式是___
【答案】2SO2+O2![]() 2SO3 使SO3凝结成固体与SO2分离 溶液颜色褪去(或变浅) 还原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
2SO3 使SO3凝结成固体与SO2分离 溶液颜色褪去(或变浅) 还原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
【解析】
装置Ⅰ中,发生反应2SO2+O2![]() 2SO3,由于反应可逆,生成的SO3中混有SO2和O2;装置Ⅱ中,冰水浴使混合气中的SO3凝结成固体;装置Ⅲ中,SO2被酸性KMnO4溶液吸收,从而使酸性KMnO4溶液褪色;装置Ⅳ用于吸收尾气,将SO2转化为Na2SO3或NaHSO3或二者的混合物。
2SO3,由于反应可逆,生成的SO3中混有SO2和O2;装置Ⅱ中,冰水浴使混合气中的SO3凝结成固体;装置Ⅲ中,SO2被酸性KMnO4溶液吸收,从而使酸性KMnO4溶液褪色;装置Ⅳ用于吸收尾气,将SO2转化为Na2SO3或NaHSO3或二者的混合物。
(1)由以上分析可知,装置 Ⅰ 模拟工业生产中SO2催化氧化的反应,其化学方程式为2SO2+O2![]() 2SO3。答案为:2SO2+O2
2SO3。答案为:2SO2+O2![]() 2SO3;
2SO3;
(2)由以上分析知,装置Ⅱ的作用是使SO3凝结成固体与SO2分离;装置Ⅲ中发生反应:5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4,观察到现象是溶液颜色褪去(或变浅),说明二氧化硫具有还原性。答案为:使SO3凝结成固体与SO2分离;溶液颜色褪去(或变浅);还原;
(3)n(NaOH)=0.040L×2.5mol/L=0.1mol,n(SO2)=![]() =0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,则装置Ⅳ中发生反应的总的化学方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案为:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。
=0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,则装置Ⅳ中发生反应的总的化学方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案为:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。

 导学教程高中新课标系列答案
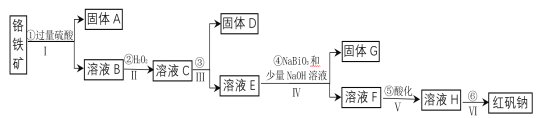
导学教程高中新课标系列答案【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42—,自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式________________。
(4)⑤中酸化是使CrO42—转化为Cr2O72—。写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。