题目内容
【题目】向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如下图所示:
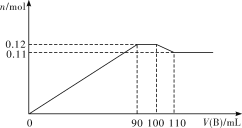
(1)当加入110 mL B溶液时,溶液中的沉淀是___________(填化学式)。
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是___________。当B溶液加到90 mL~100 mL这一段时间中,所发生的离子反应方程式是____________________。
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中。
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/mol·L-1 |
【答案】(1)BaSO4、Fe(OH)3(各1分)
(2)1∶1(1分)Ba2++SO42-=BaSO4↓、
Al(OH)3+OH-=AlO2-+2H2O(各1分)
(3)
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/mol·L-1 | 1 | 1 | 1 | 0.2 | 0.1 |
【解析】
试题分析:溶液中只有Fe3+被完全沉淀以后,Al3+才开始沉淀。
(1)图中第一段曲线生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且加入B溶液90mL时,Fe3+、Al3+恰好沉淀,当加入110mLB溶液时,溶液中的沉淀是BaSO4、Fe(OH)3;
(2)图中第二段曲线为平行直线,沉淀总物质的量没有增减,故这段是由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,有关反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,Ba2++SO42-=BaSO4↓;
(3)图中第三段曲线中,加入B溶液100mL时,Ba2+恰好沉淀完全,这段中Al(OH)3继续溶解,B为110mL时,沉淀中Al(OH)3已完全溶解,溶解了(0.12-0.11)mol=0.01mol,消耗了10mLB溶液,
Al(OH)3+OH-=AlO2-+2H2O
0.01mol 0.01mol
故c(NaOH)=0.01mol÷0.01L=1mol/L,则共加入Na2SO4为0.01mol,故c(Na2SO4)=0.01mol÷0.01L =1mol/L,而整个反应过程共生成BaSO4为0.1L×1mol/L=0.1(mol)故A溶液中c(Ba2+)=0.1mol÷0.1L=1mol/L。图中第四段曲线中,沉淀为Fe(OH)3、BaSO4共0.11mol,BaSO4为0.1mol,则Fe(OH)3为(0.11-0.1)mol=0.01mol,A中c(Fe3+)=0.01mol÷0.1L=0.1mol/L;第二、三段曲线共消耗B溶液20mL,n(NaOH)=1mol×0.02mol/L=0.02mol,据Al(OH)3+OH-=AlO2-+2H2O,则共溶解的Al(OH)3为0.02mol,则A中c(Al3+)=0.02mol÷0.1L=0.2mol/L。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案