题目内容
【题目】实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是 ,氧化产物是 ,用双线桥法表示上述反应电子转移方向和数目;
(2)计算当有73.0克HCl被氧化时,消耗MnO2的物质的量为 ;
(3)在反应MnO2+4HCI![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
【答案】(1)MnO2;Cl2;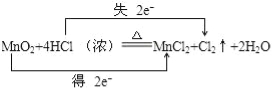 ;
;
(2)1mol
(3)2.24L
【解析】
试题分析:(1)MnO2中Mn元素化合价降低,MnO2是氧化剂,HCl中氯元素化合价升高,被氧化为氯气,Cl2是氧化产物;用双线桥法表示上述反应电子转移方向和数目
(2)73.0克HCl的物质的量是2mol,2molHCl被氧化时转移电子2mol,根据电子守恒,消耗MnO2的物质的量为1mol;
(3)在反应MnO2+4HCI![]() MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气1mol,体积(标准状况)是22.4L。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气1mol,体积(标准状况)是22.4L。

练习册系列答案
相关题目
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)ΔH>0
MgO(s)+CO2(g)+SO2(g)ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |