题目内容
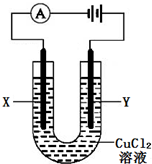
在25℃时,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28gCu生成.试回答下列问题:
(1)总反应式为______.
(2)电解过程中转移的电子数为______mol,同时生成标准状况下气体的体积为______.
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为______(KspCu(OH)2=2×10-20).
(1)总反应式为______.
(2)电解过程中转移的电子数为______mol,同时生成标准状况下气体的体积为______.
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为______(KspCu(OH)2=2×10-20).
(1)电解硫酸铜时,阳极上是氢氧根放电,阴极上是铜离子放电,电解原理方程式为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有1.28gCu生成时,转移电子为
×2=0.04mol,消耗铜离子的物质的量是0.02mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当转移0.04mol电子时,则减少的氢氧根的浓度为0.04mol/L,生成氧气的物质的量是0.01mol,标准状况体积为0.224L;
故答案为:0.04;0.224L;
(3)在原CuSO4溶液中,铜离子的物质的量是0.02mol,浓度是0.02mol/L,如要生成Cu(OH)2沉淀,根据Ksp=c(Cu2+)?c(OH-)2得c(OH-)=
=10-9mol/L,c(H+)=10-5mol/L,应调整溶液的PH为5;
故答案为:5.
| ||
故答案为:2CuSO4+2H2O
| ||
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有1.28gCu生成时,转移电子为
| 1.28g |
| 64g/mol |
故答案为:0.04;0.224L;
(3)在原CuSO4溶液中,铜离子的物质的量是0.02mol,浓度是0.02mol/L,如要生成Cu(OH)2沉淀,根据Ksp=c(Cu2+)?c(OH-)2得c(OH-)=
|
|
故答案为:5.

练习册系列答案
相关题目