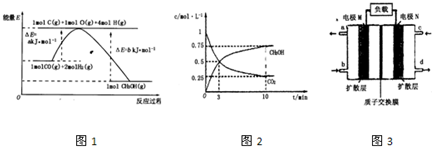
题目内容
相同温度、相同物质的量浓度的四种溶液:①CH3COONa;②NaHSO4;③;NH4Cl;④NaCl⑤NaHCO3⑥NaCN按pH由大到小的顺序排列,正确的是( )
分析:根据溶液的酸碱性以及利用盐类的水解程度比较浓度相同的溶液的pH大小.
解答:解:同温度相同物质的量浓度下列溶液中,②NaHSO4为强酸的酸式盐,水溶液呈酸性,③NH4Cl中铵根离子水解导致溶液显示酸性,但是酸性小于硫酸氢钠,⑤NaHCO3、①CH3COONa、⑥NaCN都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,PH越大,酸根离子的水解程度大小为CH3COO-<HCO3-<CN-,所以溶液PH⑥>⑤>①,由大到小的顺序⑥>⑤>①>④>③>②,故选B.
点评:本题考查了溶液PH的大小比较方法应用,主要是离子水解的应用,酸越弱,阴离子水解程度越大.

练习册系列答案
相关题目
 2Z
2Z