题目内容
7.下列有关电解质溶液的说法正确的是( )| A. | Na2SO3溶液加水稀释后,pH和Kw均减小 | |
| B. | 0.1mol/L Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) | |
| C. | 浓度分别为0.2mol/L和0.1mol/L的CH3COOH溶液中,c(H+)之比小于2:1 | |
| D. | 室温下,pH=12的氨水与pH=2的H2SO4溶液等体积混合后,溶液呈酸性 |
分析 A、Kw只受温度影响;
B、据溶液中的质子守恒判断;
C、醋酸浓度越低,电离程度越大;
D、氢离子浓度与氢氧根离子浓度相同的强酸与弱碱溶液等体积混合,弱碱过量.
解答 解:A、亚硫酸钠溶液显碱性,加水稀释,溶液碱性减弱,pH减小,但Kw不变,故A错误;
B、据质子守恒,Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故B错误;
C、醋酸浓度越小,其电离程度越大,所以0.2mol/L和0.1mol/L的CH3COOH溶液中,c(H+)之比小于2:1,故C正确;
D、pH=12的氨水与pH=2的H2SO4溶液等体积混合后,得到硫酸铵和氨水的混合物,氨水浓度远大于硫酸铵,溶液显碱性,故D错误;
故选C.
点评 本题考查了水的离子积常数只受温度影响、溶液中的质子守恒、弱酸电离平衡的影响因素、氢离子浓度与氢氧根离子浓度相同的酸与碱溶液等体积混合,混合溶液的酸碱性,注意氢离子浓度与氢氧根离子浓度相同的酸与碱溶液等体积混合,谁弱显谁性.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
20.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
18.氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,该族元素的化合物在研究和生产中有许多重要用途.下列有关说法正确的( )
| A. | H2O2、H2S、H2Se分子中均只含极性键 | |
| B. | 沸点:H2O<H2S<H2Se | |
| C. | 稳定性:H2O<H2S<H2Se | |
| D. | 上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4 |
15.下列各组物质中,化学键类型和化合物类型都相同的是( )
| A. | SO2和H2O | B. | CO2和Na2CO3 | C. | KOH和NaCl | D. | NaCl和HCl |
2.下列离子方程式书写不正确的是( )
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S=2HS- |
12.下列属于吸热反应的是( )
| A. | 液态水气化 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
 .
.
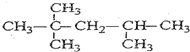 .
.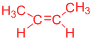 、
、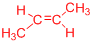 .
.