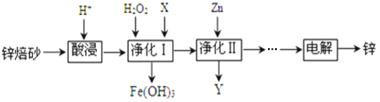
题目内容
【题目】现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________,该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
【答案】(1)Ba(OH)2(2)CO22H++CO32-=H2O+CO2↑
(3)①NaHSO4 先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-
②2H++BaCO3=Ba2++H2O+CO2↑
【解析】
试题分析:可溶性物质A、B、C,C是碱,则C中含有OH-和Na+ 或Ba2+,碳酸钡和硫酸钡都是沉淀,所以C是Ba(OH)2;A、B是盐,且都是可溶性盐,A溶液与B溶液反应可生成气体X,则应该是硫酸氢钠和碳酸钠,A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸,则D应该是BaCO3,则A是Na2CO3,B是NaHSO4,E是BaSO4。
(1)通过以上分析,C是氢氧化钡,其化学式为Ba(OH)2;
(2)A是碳酸钠、B是硫酸氢钠,二者反应生成二氧化碳,所以X是CO2,离子方程式为2H++CO32-=H2O+CO2↑;
(3)①通过以上分析知,B的化学式为NaHSO4,B中阴离子为硫酸根离子,其检验方法是先加稀盐酸除去其它离子干扰,然后再滴加氯化钡溶液,如果有白色沉淀生成,就说明含有硫酸根离子;
②D是碳酸钡,碳酸钡和稀硝酸反应生成硝酸钡、二氧化碳和水,离子方程式为2H++BaCO3=Ba2++H2O+CO2↑。