题目内容
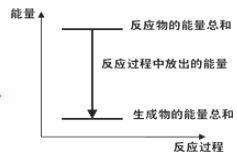
【题目】化学反应 Zn(s) +H2SO4(aq)==ZnSO4(aq) +H2(g)的反应过程如下图所示, 下列叙述中不正确的是( )
A. 若将该反应设计成原电池,正极可以是C 棒或 Fe 棒
B. 反应过程中滴加少量CuSO4 溶液可加快该反应的反应速率
C. H2SO4 的总能量大于ZnSO4 的总能量
D. 若将该反应设计成原电池,当有 32. 5g 锌溶解时,正极产生的气体在标的体积为 11. 2L
【答案】C
【解析】
A.将Zn和硫酸的改成原电池,Zn失去电子作负极,那么正极的电极材料可以选择惰性电极或者活动性比Zn弱的金属,所以正极材料可以为C棒和Fe棒;A项正确,不符合题意;
B.加入少量的CuSO4,Zn会置换出Cu。有活动性不同的金属Zn和Cu作电极,电解质溶液为H2SO4,形成原电池,可以加快氧化还原速率,B项正确,不符合题意;
C.根据图示,可以知道反应物的总能量大于生成物的总能量,即Zn和H2SO4的总能量大于ZnSO4和H2的总能量。但是不知道H2SO4的能量和ZnSO4能量的相对大小,C项错误,不符合题意;
D.1molZn转移2mol电子,生成1molH2,在标准状况下的体积为22.4L。32.5gZn为0.5molZn,转移1mol电子,生成0.5molH2,在标准状况下的体积为11,2L,D项正确,不符合题意;
本题答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.2 | 0.1 | 0.1 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.2 |
A. 反应可表示为3X+Y![]() 2Z
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则平衡向右移动


