题目内容
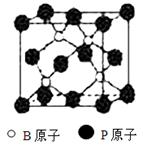
(9分)磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)写出基态磷原子的外围电子轨道表示式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。

(1)写出基态磷原子的外围电子轨道表示式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
(1) 略 (1分)
(2) 原子晶体(1分) , sp3 (1分)
(3) > (1分) (4) B(2分)
(5) 非极性(1分)
(6) 它们都是原子晶体,但B-N键比B-P键键长短,键能大,熔点高 (2分)
(2) 原子晶体(1分) , sp3 (1分)
(3) > (1分) (4) B(2分)
(5) 非极性(1分)
(6) 它们都是原子晶体,但B-N键比B-P键键长短,键能大,熔点高 (2分)
试题分析:(1)基态磷原子的外围电子轨道表示式3s23p3;
(2)根据磷化硼的组成可以判断,是原子晶体;根据空间立体结构推知是sp3杂化方式。
(3)氮在硼的上一周期,原子半径小,电负性:N >B;
(4)B原子具有多余的空轨道,而p原子具有孤对电子,提供空轨道是B原子。
(5)BBr3分子中,B原子采取sp2杂化,是平面三角形,则BBr3属于非极性分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是磷原子的半径比氮原子大,N—B键的键长比P—B键的键长短,键能相应就大,因而熔点就高
点评:根据杂化方式判断晶体的构型及分子的极性要熟练掌握。

练习册系列答案
相关题目

 )中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8
)中平均含有的碳原子数、碘晶体晶胞中平均含有的原子数均为8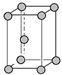 中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12
中锌原子的配位数、氯化钠晶体中距离钠离子最近且相等的钠离子数均为12