题目内容
【题目】人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
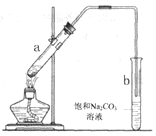
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如图:

在阳极区发生的反应包括 和H ++ ![]()
![]() H2O + CO2↑。简述
H2O + CO2↑。简述![]() 在阴极区再生的原理 。
在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25 ℃,101 kPa下:H2(g) +![]() O2(g)
O2(g) ![]() H2O(g) Δ H1= 242 kJ/mol
H2O(g) Δ H1= 242 kJ/mol
CH3OH(g) +![]() O2(g)
O2(g) ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。

(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示,下列说法正确的是 。

A.p1> p2> p3>p4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1> T2> T3>T4
D.T4、p4时,H2的平衡转化率为60%
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。

【答案】(1)①4OH 4e![]() 2H2O + O2↑(或2H2O4e
2H2O + O2↑(或2H2O4e![]() 4H+ + O2↑) ②
4H+ + O2↑) ②![]() 存在电离平衡:
存在电离平衡:![]()
![]() H+ +
H+ +![]() ,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与
,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与![]() 反应,从而使
反应,从而使![]() 再生)
再生)
(2)①CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H = 50 kJ/mol ②a
CH3OH(g) + H2O(g) △H = 50 kJ/mol ②a
(3)ACD
(4)不变 CH3OH + H2O 6e![]() 6H++ CO2↑
6H++ CO2↑
【解析】本题考查电解池原理,热化学方程式的书写,化学平衡移动原理,原电池原理。
(1)在阳极区水电离产生的氢氧根离子放电生成氧气和氢离子,氢离子再与碳酸氢根离子结合生成二氧化碳气体和水,电极反应式为:①4OH 4e![]() 2H2O + O2↑(或2H2O4e
2H2O + O2↑(或2H2O4e![]() 4H+ + O2↑)②
4H+ + O2↑)②![]() 存在电离平衡:
存在电离平衡:![]()
![]() H+ +
H+ +![]() ,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与
,阴极H+放电,浓度减小平衡右移(或溶液中H+放电,增大了OH –浓度,与![]() 反应,从而使
反应,从而使![]() 再生)。
再生)。
(2)①H2(g) + 1/2 O2(g) ![]() H2O(g) Δ
H2O(g) Δ![]() CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol,3乘以第一个反应再减去第二个反应即得CO2和H2生成气态甲醇等产物的热化学方程式:CO2(g) + 3H2(g)
CO2 (g) + 2 H2O(g) Δ H2= 676 kJ/mol,3乘以第一个反应再减去第二个反应即得CO2和H2生成气态甲醇等产物的热化学方程式:CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) △H = 50 kJ/mol。②根据反应方程式,合成甲醇的反应是放热反应,反应物总能量大于生成物总能量,等物质的量的同种物质气态能量高于液态,故选a。
CH3OH(g) + H2O(g) △H = 50 kJ/mol。②根据反应方程式,合成甲醇的反应是放热反应,反应物总能量大于生成物总能量,等物质的量的同种物质气态能量高于液态,故选a。
(3) A.根据反应方程式,温度相同时压强增大,合成甲醇的反应正向移动,平衡时甲醇的物质的量分数增大,由图像知p1> p2> p3>p4,正确;B.化学方程式确定时平衡常数只与温度有关,甲醇的物质的量分数高,反应的平衡常数可能相等,错误;C.温度升高,平衡逆向移动,平衡时甲醇的物质的量分数减小,图示中,该反应的温度变化为:T1> T2> T3>T4,正确;D.T4、p4时甲醇物质的量分数为0.2,设甲醇物质的量为x。
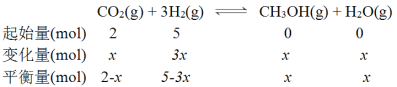
![]() ,x=1,H2的平衡转化率,3/5×100%=60%,正确,故选ACD。
,x=1,H2的平衡转化率,3/5×100%=60%,正确,故选ACD。
(4)B电极室是电池的正极,氧气得到电子与氢离子结合生成水,溶液体积变化忽略,所以工作结束后,B电极室溶液的pH与工作前不变;负极甲醇失去电子生成二氧化碳和氢离子,电极反应式为:CH3OH + H2O 6e![]() 6H++ CO2↑。
6H++ CO2↑。