题目内容
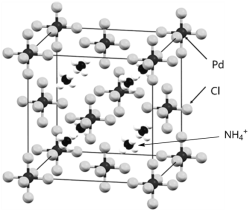
【题目】下图是一种钯(Pd)的氯配合物X的晶胞结构。回答下列问题:
请回答下列问题:
(1)基态Cl原子中存在未成对电子的能级,画出其该能级的轨道表示式______。
(2)下列关于Cl元素的叙述正确的是______ (填序号)。
A.Cl2分子中无π键 B.Cl是p区主族元素
C.第一电离能:Cl<S D.电负性:Cl>S
(3)NCl3分子的中心原子N的杂化方式是______。
(4) NH3常作制冷剂,其键角______ (填“大于”或“小于”)NH4+的键角,NH3的沸点高于N2沸点的主要原因是______。
(5) 物质X的晶体类型为______,其中的Pd元素的化合价为______、配位数为______。
(6) 配合物Y是含有Pd的平面四方的配合物,经过元素分析与计算可知Y中Pd : Cl : N : H的数量比=1:2:2:6。试画出配合物Y的可能结构______。
【答案】![]() ABD sp3 小于 NH3分子间有氢键,N2分子间无氢键,氢键使NH3的沸点更高 离子晶体 +4 6
ABD sp3 小于 NH3分子间有氢键,N2分子间无氢键,氢键使NH3的沸点更高 离子晶体 +4 6 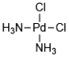
【解析】
(1)基态Cl原子的电子排布式为1s22s22p63s23p5,据此分析解答;
(2)根据Cl2分子的结构式为Cl-Cl和Cl原子的电子排布式为1s22s22p63s23p5结合元素周期律分析判断;
(3)NCl3分子的中心原子N上含有3个N-Clσ键,还含有1个孤电子对,据此分析解答;
(4) 孤电子对与成键电子对间的排斥力大于成键电子对与成键电子对间的排斥力,据此判断键角的大小;结合氢键对物质性质的影响分析解答;
(5) 根据物质X的晶体结构图,结构中含有![]() 等微粒,每个Pd原子周围有6个Cl原子,根据均摊法计算Pd原子和Cl原子数,同时判断含有的
等微粒,每个Pd原子周围有6个Cl原子,根据均摊法计算Pd原子和Cl原子数,同时判断含有的![]() 数,再根据化合价的代数和为0,计算Pd元素的化合价;
数,再根据化合价的代数和为0,计算Pd元素的化合价;
(6) 配合物Y是含有Pd的平面四方的配合物,说明Pd在四边形的内部,结合Y中Pd : Cl : N : H的数量比=1:2:2:6,分析判断可能的结构。
(1)基态Cl原子的电子排布式为1s22s22p63s23p5,其中存在未成对电子的能级为3p,该能级的轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)A.Cl2分子的结构式为Cl-Cl,分子中无π键,故A正确;
B.Cl原子的电子排布式为1s22s22p63s23p5,是p区主族元素,故B正确;
C.同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,因此第一电离能:Cl>S,故C错误;
D.元素的非金属性越强,电负性越大,电负性:Cl>S,故D正确;
故答案为:ABD;
(3)NCl3分子的中心原子N上含有3个N-Clσ键,还含有1个孤电子对,价层电子对数为4,杂化方式是sp3,故答案为:sp3;
(4) 孤电子对与成键电子对间的排斥力大于成键电子对与成键电子对间的排斥力,NH3分子中存在孤电子对,使得键角小于NH4+的键角,NH3分子间存在氢键,使得氨气的沸点高于N2沸点,故答案为:小于;NH3分子间有氢键,N2分子间无氢键,致使NH3的沸点更高;
(5) 根据物质X的晶体结构图,结构中含有![]() 等微粒,说明该晶体属于离子晶体;根据图示,每个Pd原子周围有6个Cl原子,Pd的配位数为6,该晶胞中含有8×
等微粒,说明该晶体属于离子晶体;根据图示,每个Pd原子周围有6个Cl原子,Pd的配位数为6,该晶胞中含有8×![]() +6×
+6×![]() =4个Pd原子,则含有24个Cl原子,同时含有8个
=4个Pd原子,则含有24个Cl原子,同时含有8个![]() ,根据化合价的代数和为0,其中Pd元素的化合价为
,根据化合价的代数和为0,其中Pd元素的化合价为![]() =+4,故答案为:离子晶体;+4;6;
=+4,故答案为:离子晶体;+4;6;
(6) 配合物Y是含有Pd的平面四方的配合物,说明Pd在平面四边形的内部,配位数为4,根据Y中Pd : Cl : N : H的数量比=1:2:2:6,则结构中含有1个Pd原子,2个Cl原子和2个氨分子,则该配合物Y的结构可为 ,故答案为:
,故答案为: 。
。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案