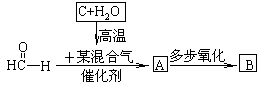
题目内容
(08上海建平中学期末) 下列物质固态时,必定是分子晶体的是 ( )
A.酸性氧化物 B.非金属单质 C.碱性氧化物 D.含氧酸
答案:D

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
(08上海建平中学期末)某同学用下列装置制备并检验Cl2的性质。
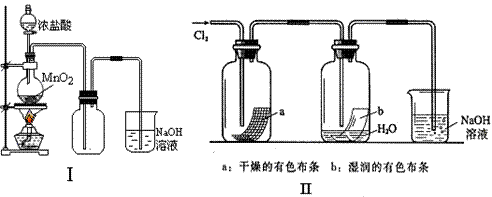 |
(1)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是
(2)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由是 。
a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高
c.Fe的密度比Cu小 d.Fe的金属性比Cu强
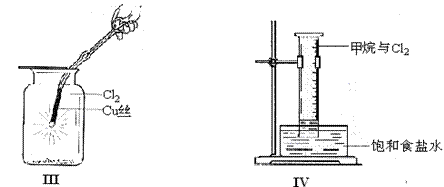
②通常由燃烧产物(FeCl3)配制其溶液的方法 。
(3)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状
液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅 ,量筒内液面上升等。
1油状液滴的成分可能是(写分子式) ,
2水槽用饱和食盐水而不用水的原因是_____________ ____________________。
3饱和食盐水中有少量固体析出,其原因是_______________ ______________。
(4)将硫酸溶液滴入II图烧杯中,至溶液显酸性,结果也有Cl2生成,该反应的离子方程
式是 。