题目内容
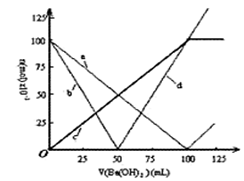
烧杯中盛有100mL1.0mol/L的NaHSO4溶液,向其中逐滴滴加1.0 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法正确的是 ( )
Ba2+ +OH—+H++SO42-=BaSO4↓+H2O

| A.曲线a表示H+的物质的量的变化 |
| B.直线d表示OH-的物质的量的变化 |
| C.曲线c表示Ba2+的物质的量的变化 |
| D.加入Ba(OH)2溶液50mL反应的离子方程式为: |
B
本题主要是考查离子反应过程中各离子的数量关系;涉及的反应有:
OH—+H+=H2O Ba2+ +SO42-=BaSO4↓
随着溶液的滴加,溶液中各离子的物质的量为:
由上表可知,加入Ba(OH)2溶液50mL时,Ba(OH)2不足,离子方程式为:
Ba2+ +2OH—+2H++SO42-=BaSO4↓+2H2O
OH—+H+=H2O Ba2+ +SO42-=BaSO4↓
随着溶液的滴加,溶液中各离子的物质的量为:
| | H+ | SO2-4 | Ba2+ | SO42- |
| 0 ml | 0.1 | 0.1 | 0 | 0 |
| 50 ml | 0 | 0.05 | 0 | 0 |
| 100 ml | 0 | 0 | 0 | 0.1 |
Ba2+ +2OH—+2H++SO42-=BaSO4↓+2H2O

练习册系列答案
相关题目
 :10
:10

 :10
:10