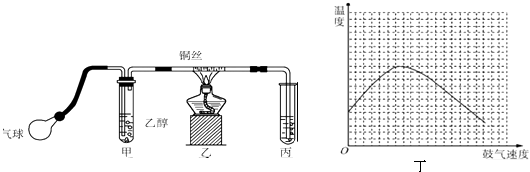
��Ŀ����
����Ŀ����~��Ϊ������Ԫ�أ��䳣�����ϼ���ԭ�������Ĺ�ϵ����ͼ��ʾ����ش��������⡣
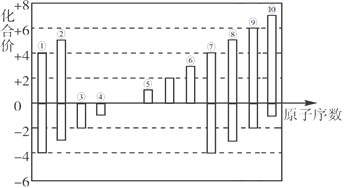
��1��������ļ����Ӱ뾶�ɴ�С��˳��Ϊ_______�������ӷ��ţ���
��2��������Ԫ���γɵ����ȶ�����õ���̬�⻯��ĵ���ʽΪ_______��
��3���ڵļ��⻯����������������ˮ������Է������Ϸ�Ӧ�����ò����а����Ļ�ѧ������Ϊ_________________��
��4��������������������ˮ���������________��________���ѧʽ����
��5��д���ĵ��ʺ͢ݵ�����������Ӧˮ�����ˮ��Һ֮�䷴Ӧ�����ӷ���ʽ��_______________________________________________��
���𰸡� Cl-��F- ![]() ���Ӽ� ���Լ� HClO4��H3PO4 2Al+2OH-+2H2O=2AlO2-+3H2��
���Ӽ� ���Լ� HClO4��H3PO4 2Al+2OH-+2H2O=2AlO2-+3H2��
����������ͼ�л��ϼۿ�֪���۵Ļ��ϼ�ֻ��-2�ۣ�û�������ϼۣ��ʢ�ΪOԪ�أ��ٵĻ��ϼ�Ϊ+4��-4�ۣ���ΪCԪ�أ����ΪN����ΪF����ֻ��+1�ۣ�ΪNa���١��ߵĻ��ϼ���ͬ���١���λ��ͬ���壬���ΪSi������Al������P����ΪSԪ�أ�����������Ϊ+7��ԭ������������ΪCl����1��ͬ������ϵ������Ӱ뾶�����ܡ���ļ����Ӱ뾶�ɴ�С��˳��ΪCl-��F-����2��������Ԫ���γɵġ��ȶ�����õ���̬�⻯����HF������ʽΪ![]() ����3���ڵļ��⻯�ﰱ����������������ˮ����������Է������Ϸ�Ӧ��������泥����ò����а����Ļ�ѧ������Ϊ���Ӽ������Լ�����4���ǽ�����Խǿ����ۺ����������Խǿ����Ԫ�طǽ�����ǿ����Ԫ�أ��ࡢ�������������ˮ���������ǿ��˳����HClO4��H3PO4����5�������ʺ͢ݵ�����������Ӧˮ�����ˮ��Һ��������֮�䷴Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O��2AlO2-+3H2����
����3���ڵļ��⻯�ﰱ����������������ˮ����������Է������Ϸ�Ӧ��������泥����ò����а����Ļ�ѧ������Ϊ���Ӽ������Լ�����4���ǽ�����Խǿ����ۺ����������Խǿ����Ԫ�طǽ�����ǿ����Ԫ�أ��ࡢ�������������ˮ���������ǿ��˳����HClO4��H3PO4����5�������ʺ͢ݵ�����������Ӧˮ�����ˮ��Һ��������֮�䷴Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O��2AlO2-+3H2����