题目内容
17. 氧化亚铜(Cu2O)作为一种重要的无机化工原料,在徐料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
氧化亚铜(Cu2O)作为一种重要的无机化工原料,在徐料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:(1)添加Cu2O的涂料或玻璃显砖红色.
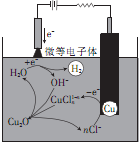
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示.
①阴极的电极反应式为2H++2e-=H2↑
②溶液中CuCl${\;}_{n}^{1-n}$转化为Cu2O的离子方程式为CuCln1-n+2OH-=Cu2O↓+H2O+2nCl-
(3)工业生产中常采用高温锻烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为:
样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+1K2SO4+8H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在酸式(填“酸式或“碱式,)滴定管中
③若产品质量为1.0g,滴定时消耗0.10mo1.L-1的KMnO4标准溶液20.00mI.,则产品中Cu2O的质量分数为72%.
分析 (1)根据氧化亚铜的颜色确定添加Cu2O的涂斜或玻璃的颜色即可;
(2)①在电解池的阴极上是溶液中的阳离子发生得电子的还原反应,根据放电顺序来回答;
②在碱性环境下,CuCln1-n和氢氧根离子之间发生反应得到转红色沉淀,据此书写离子方程式;
(3)①反应中化合价升高的元素是Fe,化合价降低的元素是Mn,根据电子守恒来配平方程式即可;
②高锰酸钾具有强氧化性,据此选择滴定管;
③根据发生的反应找到Cu2O和KMnO4之间的关系式,进行相应的计算即可.
解答 解:(1)氧化亚铜的颜色是砖红色,所以添加Cu2O的涂斜或玻璃显砖红色,故答案为:砖红;
(2)①在电解池的阴极上是溶液中的阳离子发生得电子的还原反应,根据放电顺序,发生的反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②在碱性环境下,CuCln1-n和氢氧根离子之间发生反应得到转红色沉淀,离子方程式CuCln1-n+2OH-=Cu2O↓+
H2O+2nCl-,
故答案为:CuCln1-n+2OH-=Cu2O↓+H2O+2nCl-;
(3)①反应FeSO4+KMnO4+H2SO4→Fe2(SO4)3+MnSO4+K2SO4+H20中化合价升高的元素是Fe,共升高2价,化合价降低的元素是Mn,降低5价,根据电子守恒,含锰元素的物质前边系数是2,铁原子数是10,硫酸亚铁前边是10,硫酸铁前边是5,根据元素守恒,配平其他物质,结果为:10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,故答案为:10;2;8;5;2;1;8;
②高锰酸钾具有强氧化性,应该选择酸式滴定管,故答案为:酸式;
③根据发生的反应Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O、10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H20,找到Cu2O和KMnO4之间的关系为:Cu2O~$\frac{2}{5}$KMnO4,产品质量为1.0g,滴定时消耗0.10mol•L-1的KMnO4标准溶液20.00mL,則产品中Cu2O的物质的量是$\frac{0.1×0.02}{0.4}$mol=0.005mol,质量分数是$\frac{0.005mol×144g/mol}{1.0g}$×100%=72%.故答案为:72%.
点评 本题综合考查学生电解原理的应用、电极反应式的书写、氧化还原反应的配平以及物质含量的测定等知识,属于综合知识的考查,难度大.

 名校课堂系列答案
名校课堂系列答案| A. | Na2CO3溶液中,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 该沉淀转化反应的平衡常数约为25 | |
| C. | 约有0.04 mol BaSO4溶解 | |
| D. | 反应后溶液中:c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+) |
| A. | 0.05 mol•L-1 | B. | 0.25 mol•L-1 | C. | 5 mol•L-1 | D. | 0.5 mol•L-1 |

(1)关于青蒿素和双氢青蒿素(结构如图)的下列说法,错误的是D
A.青蒿素的分子式为C15H22O5
B.由青蒿素制备双氢青蒿素的反应属于还原反应
C.青蒿素分子中含有过氧链和酯基、醚键
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)水煎青蒿治疗疟疾,药性很不稳定,效果很差.屠呦呦改用乙醇控温60℃,药效显著提高,这说明青蒿素的性质可溶于乙醇、对热不稳定.
(3)经过190次提取失败后,1971年屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是D(填如表中的编号).
| A | B | C | D | |
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点/℃ | 180~310℃ | 97.4 | 76.5 | 34.5 |
| A. | CO2 | B. | H2O | C. | Br2 | D. | Na2O2 |
| A. | 用明矾作净水剂 | B. | 用硫磺粉处理散落在地上的汞 | ||
| C. | 用食醋清洗水壶中的水垢 | D. | 服用复方氢氧化铝片治疗胃酸过多 |
| A. | 金属钠由于很容易与氧气反应,因此无法用来冶炼金属 | |
| B. | 电解法、热还原法都可以用来冶炼金属铜 | |
| C. | 增大压强对于合成氨和三氧化硫的合成都是有利的,因此反应设备都需要耐高压 | |
| D. | 石灰水中通入氯气是用于工业合成漂白粉的有效手段 |
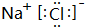 ;
;