题目内容
NO2-是一种常见配体,在八面体配离子[MR2(NO2)4]-中,中心离子M含量为21.27%,氮元素的含量为30.33%,只检测到一种N-O键长,请回答下列问题
⑴ 给出自由状态下的NO2-的结构,NO2-在该配合物中配位方式
⑵ 通过计算,给出配离子的化学式和名称
⑶ 画出该配离子的结构
⑴ 给出自由状态下的NO2-的结构,NO2-在该配合物中配位方式
⑵ 通过计算,给出配离子的化学式和名称
⑶ 画出该配离子的结构
⑴NO2-为角型,(1分)由于只一种N-O键长,应为氮原子配位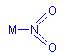 (1分)
(1分)
⑵ 若R中不含N,则氧元素含量为(0.3033/14) x32=0.6933,M,N,O之和将超过1,是不可能的。所以R必为含氮配体。设R中含x个N,则有
nM : nN = 0.2127/MM : 0.3033/14.01 =" 1" :(2x+ 4)MM=19.65(x+2)
x=1时,有合理解,MM="58.95" 为Co元素,(元素,1分)
配离子摩尔质量=277g/mol,
扣除掉1个Co,6个N,8个O后还剩下6,应为6个H,故配体R为NH3,
配离子化学式为[Co(NH3)2(NO2)4]-, (化学式,2分)
名称为四亚硝酸根·二氨合钴(|||)离子 (1分)
⑶ 由于只一种N-O键长,所有氧原子等价,则配离子结构应为:
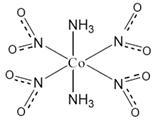 (2分)
(2分)
 (1分)
(1分)⑵ 若R中不含N,则氧元素含量为(0.3033/14) x32=0.6933,M,N,O之和将超过1,是不可能的。所以R必为含氮配体。设R中含x个N,则有
nM : nN = 0.2127/MM : 0.3033/14.01 =" 1" :(2x+ 4)MM=19.65(x+2)
x=1时,有合理解,MM="58.95" 为Co元素,(元素,1分)
配离子摩尔质量=277g/mol,
扣除掉1个Co,6个N,8个O后还剩下6,应为6个H,故配体R为NH3,
配离子化学式为[Co(NH3)2(NO2)4]-, (化学式,2分)
名称为四亚硝酸根·二氨合钴(|||)离子 (1分)
⑶ 由于只一种N-O键长,所有氧原子等价,则配离子结构应为:
 (2分)
(2分)⑴ NO2-是3中心,18电子构型的分子,是O3的等电子体,因此构型为角型,并存在一个3中心4电子π键。由于配合物中只检测出一种N-O键长,所以可以肯定,NO2-(两可配体,即N、O都可做配位原子)以N作为配位原子。
⑵ 从题目所给的条件分析,由于不知中心原子的种类,因此无法根据中心原子的摩尔质量和质量百分数确定配合物的摩尔质量;虽然知道N的百分含量,但是由于不确定配体R中是否含有,以及含有几个氮原子,所以必须设R中含有x(x≥0)个N原子,根据元素分析法,讨论中心原子的摩尔质量,即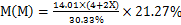 (g/mol),通过讨论,只有x=1时,M(M)=58.95g/mol符合题意。即M为Co。该配合物有两种配体,NO2-、NH3,先阴离子,后中性分子,先无机,后有机的原则安排配体的顺序,不同的配体之间打“·”,配体和中心离子之间加“合”,并在中心原子的后面要标出该中心原子的氧化数。
(g/mol),通过讨论,只有x=1时,M(M)=58.95g/mol符合题意。即M为Co。该配合物有两种配体,NO2-、NH3,先阴离子,后中性分子,先无机,后有机的原则安排配体的顺序,不同的配体之间打“·”,配体和中心离子之间加“合”,并在中心原子的后面要标出该中心原子的氧化数。
⑶ 根据题意,该八面体结构存在两种异构体,即顺式结构和反式结构。便是顺式结构存在两种不同的Co-N配位键,因此会造成N-O键长也会出现两种。因此只能为反式结构,如下图所示:

⑵ 从题目所给的条件分析,由于不知中心原子的种类,因此无法根据中心原子的摩尔质量和质量百分数确定配合物的摩尔质量;虽然知道N的百分含量,但是由于不确定配体R中是否含有,以及含有几个氮原子,所以必须设R中含有x(x≥0)个N原子,根据元素分析法,讨论中心原子的摩尔质量,即
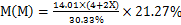 (g/mol),通过讨论,只有x=1时,M(M)=58.95g/mol符合题意。即M为Co。该配合物有两种配体,NO2-、NH3,先阴离子,后中性分子,先无机,后有机的原则安排配体的顺序,不同的配体之间打“·”,配体和中心离子之间加“合”,并在中心原子的后面要标出该中心原子的氧化数。
(g/mol),通过讨论,只有x=1时,M(M)=58.95g/mol符合题意。即M为Co。该配合物有两种配体,NO2-、NH3,先阴离子,后中性分子,先无机,后有机的原则安排配体的顺序,不同的配体之间打“·”,配体和中心离子之间加“合”,并在中心原子的后面要标出该中心原子的氧化数。⑶ 根据题意,该八面体结构存在两种异构体,即顺式结构和反式结构。便是顺式结构存在两种不同的Co-N配位键,因此会造成N-O键长也会出现两种。因此只能为反式结构,如下图所示:


练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目