题目内容
在标准状况下,将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO和NO2组成的混合气体1.12 L,则混合气体中NO的体积为
| A.112 mL | B.1 008 mL |
| C.224 mL | D.448 mL |
A ?
解有关金属与HNO3反应的题目时充分利用守恒思想:①利用氮原子守恒得:n(NO)+n(NO2)==0.05 mol ②利用电子转移守恒得:n(NO)×3+n(NO2)×1=n(Cu)×2,即n(NO)×3+n(NO2)×1=×2,解得
则V(NO)=112 mL,A项正确。
则V(NO)=112 mL,A项正确。

练习册系列答案
相关题目
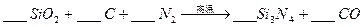
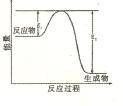 该反应过程中的能量变化如图所示,回答下列问题。
该反应过程中的能量变化如图所示,回答下列问题。 硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO
硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO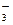 )=3mol/L,
)=3mol/L, mol
mol /L。
/L。